2 страница. Токсическое действие (эффект) на организм проявляется только при условии достаточного количества ксенобиотика
Токсическое действие (эффект) на организм проявляется только при условии достаточного количества ксенобиотика. Если это количество незначительно для развития токсического эффекта, то его не будет либо фактически, либо в силу его практической незаметности.
Разовьется или нет отравление вслед за поступлением ксенобиотика в организм, какова будет степень его проявления, насколько долго оно будет продолжаться, зависит от вида ксенобиотика и его рецептора (рецепторов). Однако в значительной мере это зависит от того, что и с какой скоростью будет происходить с веществом в организме. С момента поступления и до взаимодействия с рецептором ксенобиотик подвергается воздействию разнообразных биологических факторов: попав в кровоток, он разносится по всему организму, на том или ином этапе проходя через печень; через эпителий капилляров проникает в ткани и органы, иногда задерживаясь и даже откладываясь в некоторых из них; в той или иной степени подвергается превращениям и, наконец, выделяется из организма в неизменном виде или в виде метаболитов. Превращения некоторых ксенобиотиков могут происходить уже в месте соприкосновения с тканями. В крови чужеродные вещества в той или иной мере вступают в связь с плазменными белками, преимущественно с альбуминами. Обычно такая связь снижает возможность взаимодействия с рецепторами и/или затягивает этот процесс. Указанные динамические процессы, которым ксенобиотик подвергается в организме, время и сила его связывания с рецепторами, интенсивность метаболизма в значительной степени обуславливают не только силу, но и сам характер его токсического действия. Все эти процессы протекают во времени. Изучением временных зависимостей их течения в организме занимается кинетика.
Токсикокинетика(хемобиокинетика) – это область изучения кинетики прохождения ядов (ксенобиотиков) через организм, включая процессы их поступления, распределения, метаболизма и выделения. Само прохождение ядов через организм хорошо иллюстрирует рис. 3.1.


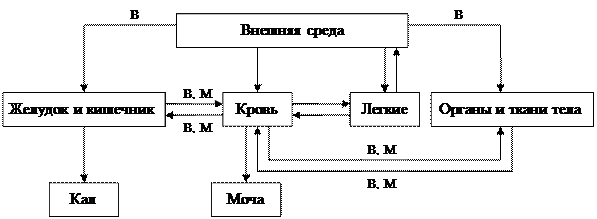
Рис. 3.1. Транспорт чужеродных веществ (В) и их метаболитов (М)
через организм
Очевидно, что в случае каждого конкретного соединения пути его поступления, дальнейшие перемещения, метаболизм и выделение из организма достаточно индивидуальны, равно как и скорость этих процессов. Иначе говоря, судьба веществ в организме и их кинетика характерны для каждого ксенобиотика. Однако в поведении ядов существуют общие закономерности, которые могут быть описаны простыми математическими выражениями, иначе – математическими моделями. И только некоторые параметры этих моделей оказываются характерными для конкретных веществ.
Основной задачей токсикокинетики является определение количественной характеристики действия вещества в организме: его содержания, содержания метаболитов в разных тканях и крови в разные моменты времени и сопоставление его с образованным эффектом [22].
Методы токсикокинетики.Методы токсикокинетики необходимы для определения чужеродных веществ в организмах или отдельных биосредах (крови, плазме, моче, тканях, вдыхаемом воздухе). К методам токсикокинетики относятся:
фотометрический или спектрофотометрический анализ;
полярография;
хроматография;
флуораметрия (люминесцентный анализ – основан на свечении веществ при поглощении световой энергии) и др.
С помощью данных методов возможно количественное определение конкретных промышленных ядов. Все эти методы используют высокочувствительные приборы (поскольку концентрации ядов невелики), поэтому изучение токсикокинетики многих ксенобиотиков производится с помощью определения радиоактивности биологических образцов, отобранных в различные интервалы времени, или организма в целом после введения в него изучаемого соединения с радиоактивной меткой.
В токсикокинетике используются три группы моделей:
графические;
математические;
реальные (вещественные).
|
|
 В представленной на рис. 3.2 модели отражен тот факт, что вещество поступает в организм (А), а затем выделяется как в неизменном виде (В), так и в виде метаболитов (М).
В представленной на рис. 3.2 модели отражен тот факт, что вещество поступает в организм (А), а затем выделяется как в неизменном виде (В), так и в виде метаболитов (М).


Рис. 3.2. Модель прохождения вещества А через организм,
представленный одночастевой системой
Распределение токсических веществ в организме зависит от трех основных факторов: пространственного, временного и концентрационного.
Пространственный фактор определяет пути поступления и распределения яда, что связано с кровоснабжением органов и тканей, поскольку количество яда, поступающее к органу, зависит от его объемного кровотока, отнесенного к единице масс тканей. Наибольшее количество яда в единицу времени обычно поступает в легкие, почки, печень, сердце, мозг, при этом отмечается несоответствие между кровотоком и токсическим поражением органов. При ингаляционных отравлениях основная часть яда поступает в почки, а при пероральных – в печень. Токсический процесс определяется не только количеством яда, накопившегося в тканях, но и чувствительностью к нему рецепторов «избирательной токсичности». Особенно опасны токсические вещества, вызывающие необратимые изменения клеточных структур, что наблюдается при химических ожогах тканей кислотами или щелочами, и не менее опасны обратимые изменения, вызывающие только функциональные расстройства, например при наркозе.
Под временным фактором подразумевается скорость поступления ксенобиотика в организм и его выведения, то есть он отражает связь между временем действия яда и его токсическим эффектом.
Концентрационный фактор определяется концентрацией яда в биологических средах, в частности в крови. Измерение концентрации яда позволяет определить токсикогенную и соматогенную стадии отравления и корректировать лечение. Исследование концентрации яда по времени позволяет обнаружить период резорбции – достижения максимальной концентрации токсического вещества в крови – и период элиминации –выведения яда из организма до полного очищения.
Кроме того, токсическое действие ксенобиотика на живые системы определяется их способностью вмешиваться в течение фундаментальных биохимических процессов и нарушать их. К фундаментальным биохимическим процессам, составляющим основу жизнедеятельности, относятся синтез белка, дыхание, энергетический обмен, метаболизм, в том числе и ксенобиотиков. Эти фундаментальные процессы связаны с определенными внутриклеточными структурами. Применительно к токсическому действию ксенобиотиков Л.А. Тиунов выделяет четыре основных структурно-метаболических комплекса:
эндоплазматический ретикулум, связанный с метаболизмом ксенобиотиков;
комплекс, связанный с процессами биосинтеза белка;
митохондриальный, связанный с процессами биоэнергетики;
лизосомный, связанный с процессами катаболизма.
Следует сказать, что эта классификация условна, поскольку многие ксенобиотики оказывают повреждающее действие на разные структурно-метаболические комплексы (например, мембранотропные яды) [22].
3.3. Поступление ксенобиотиков в организм
С поступлением в организм чужеродных химических соединений (ксенобиотиков) происходит их накопление (если они не подвергаются или почти не подвергаются биотрансформации). Процесс накопления является результатом динамического распределительного процесса, в котором кровь играет роль промежуточной фазы: получая вещество, кровь отдает его тканям, различающимся кровоснабжением и «емкостью» для данного вещества. В результате отмечается накопление достаточно устойчивых ксенобиотиков в крови, рост их концентрации в артериях на первых порах заметно обгоняет рост концентрации в венах. С течением времени, по мере насыщения тканей, различие между содержанием вещества в артериальной и венозной крови постепенно уменьшается (рис. 3.3). Непосредственным отражением этого процесса является увеличение концентрации ксенобиотика в выдыхаемом воздухе, что и отражает процесс накопления яда в организме.
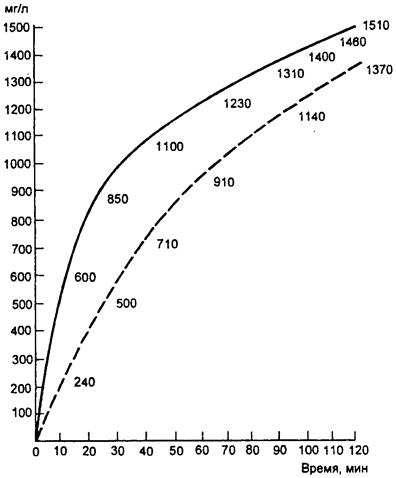
Рис. 3.3. Динамика концентрации этилового эфира в артериальной (сплошная кривая) и венозной (пунктирная кривая) крови собаки
при вдыхании его паров в концентрации 2000 мг/л
Накопление (кумуляция) ксенобиотика в тканях организма может иметь место при его постоянном или периодическом поступлении в организм тем или иным путем или одновременно несколькими путями. При этом поступление должно превышать очищение организма от яда за счет всех возможностей, то есть выделения различными путями и метаболизма, иначе накопление не произойдет. Например, известна кумуляция свинца и стронция за счет их прочного связывания с костной тканью и весьма медленного выделения из нее.
Накопление устойчивых соединений в крови и тканях может быть описано экспоненциальной зависимостью, что наглядно представлено на рис. 3.4, где даны экспериментальная и теоретическая кривые насыщения сальника крыс бензолом при вдыхании его паров.
Математическое описание этого процесса, то есть его математическая модель такова:
Ct = λC0(1 – e-kt),
где Ct – концентрация ксенобиотика в организме в момент времени t;
λ – коэффициент распределения ксенобиотика между биофазой (сальником крыс) и окружающей средой; C0 – постоянная концентрация вещества в окружающей среде; k – постоянная величина накопления вещества в биофазе (сальнике), которая является постоянной частью от максимально возможного количества вещества в биологической системе, накапливающегося в каждую единицу времени; t – текущее время.
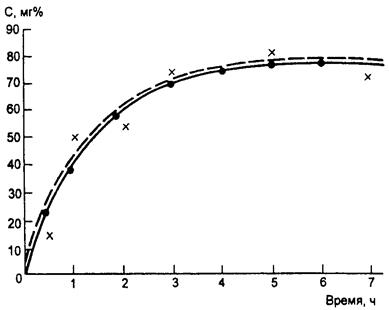
Рис. 3.4. Сопоставление экспериментальной кривой насыщения сальника крыс бензолом при вдыхании его паров в концентрации 3 мг/л (пунктирная кривая) с теоретической экспонентой этого процесса (сплошная кривая)
Приведенный пример свидетельствует об экспоненциальном характере накопления устойчивых соединений в отдельных тканях организма, которые могут быть смоделированы одночастевой системой. Для моделирования организма используется многочастевая система, математически описываемая суперпозицией экспонент [22].
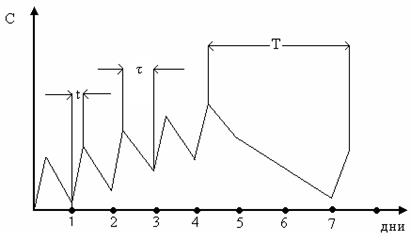
Периодическое поступление ксенобиотиков. Рассмотрим довольно типичный случай процесса накопления ксенобиотика в организме на примере вдыхания газообразного вещества на производстве в условиях пятидневной рабочей недели. Для возможности математического описания процесса примем постоянство основных условий: концентрации вдыхаемого вещества в воздухе рабочего помещения, времени ежедневного пребывания работника в этом помещении t, сменяемого постоянным периодом отдыха и сна τ, при этом в конце недели период отдыха составляет два дня Т. Примем также, что очищение организма от вещества происходит достаточно медленно (альтернатива – время свободного выделения вещества мало по сравнению со временем накопления). Графическая модель процесса представлена на рис. 3.5.
Если представить, что накопление ксенобиотика в организме и его выделение следуют кинетике первого порядка, то есть организм является одночастевой системой, накопление ксенобиотика в организме (его отдельных тканях) описывается уже известным уравнением Ct = λC0(1 – e-kt), а выделение – простой экспонентой C = λCt(e-xt). Содержание ксенобиотика в организме после любого n-го рабочего дня первой недели описывается уравнением
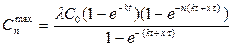 .
.
К началу следующего рабочего дня первой недели содержание ксенобиотиков составит
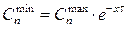 .
.
|
Рис. 3.5. Процесс насыщения и освобождения тканей от газообразного
ксенобиотика в условиях пятидневной рабочей недели
Теперь рассмотрим вариант с рабочей неделей, состоящей из а рабочих дней, включающих период работы t и период отдыха τ, а также период длительного отдыха Т (выходные дни), как это представлено на рис. 3.5. Тогда содержание вещества в организме в конце любого рабочего дня p, принадлежащего (m + 1) неделе, можно найти из уравнения
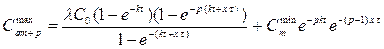 .
.
Накопление ксенобиотиков, претерпевающих биотрансформацию. В этом случае картина накопления ксенобиотика усложняется по сравнению с накоплением вещества инертного, не подверженного метаболизму:
 |
Модель процесса такова: среда содержит ксенобиотик в постоянной концентрации С0; биологическая система, в которую он проникает в соответствии с кинетикой первого порядка, может быть интерпретирована одночастевой моделью; метаболизм ксенобиотика в биологической системе зависит от ее особенностей и природы ксенобиотика. Математическая модель выглядит так:
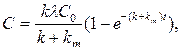
где С – концентрация ксенобиотика в биологической системе в момент времени t; k – постоянная накопления вещества; λ – коэффициент распределения ксенобиотиков между средой и биологической системой; km – постоянная его метаболизма.
Возможны три частных случая. Первый – накопление происходит значительно быстрее метаболизма, то есть k > km, тогда можно пренебречь km по сравнению с k и уравнение примет вид
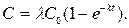
Это уже известное нам уравнение неметаболирующих соединений.
Второй случай – скорости накопления и метаболизма равны, то есть
k = km. В этом случае
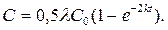
Третий случай – скорость метаболизма значительно превышает скорость накопления, то есть k < km, тогда
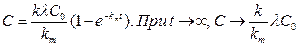 .
.
Следовательно, накопление ксенобиотика в биологической системе и в этом случае имеется, но оно мало, тем меньше, чем меньше k по сравнению с km. С увеличением разницы между постоянными накопления и метаболизма предел накопления ксенобиотика стремится к нулю.
3.4. Выделение ксенобиотиков из организма
Освобождение организма от ксенобиотиков и их метаболитов происходит разными путями, главные из которых – почки и кишечник. Элиминация (выделение) летучих соединений, нередко присутствующих в производственной среде, атмосферном воздухе или жилых помещениях, в значительной степени осуществляется с выдыхаемым воздухом. Как правило, с выдыхаемым воздухом выделяются неизменные вещества сами по себе или вместе со своими ближайшими летучими метаболитами. Очень редко в процессе метаболизма из нелетучих соединений образуются летучие. В этих случаях они могут выделяться через легкие.
Растворимые в воде соединения выделяются главным образом через почки, то есть с мочой. В процессе метаболизма происходит преимущественное увеличение полярности, а следовательно, и водорастворимости метаболитов по сравнению с исходными соединениями. Это повышает возможности их выделения с мочой. Меньшую роль играет выделение через желудочно-кишечный тракт; большое практическое значение этот путь выделения имеет для солей тяжелых металлов. Некоторое количество отдельных ксенобиотиков может выделяться с потом, слюной и молоком.
Достаточно часто токсические вещества и их метаболиты выделяются сразу несколькими путями, причем преимущественное значение имеет какой-либо один из них. Примером может быть этиловый спирт. Большая часть спирта подвергается в организме превращениям. Остальная часть, примерно 10% от общего количества, выделяется в неизменном виде главным образом с выдыхаемым воздухом, затем с мочой и в небольшом количестве с калом, слюной и молоком.
Если биологический объект, из которого выделяется ксенобиотик, можно моделировать одночастевой системой, то процесс выделения описывается простой экспонентой, которая имеет вид
C = λCte-xt,
где Ct – концентрация ксенобиотика в организме в момент времени t;
x – постоянная выделения, показывающая, какая часть от имеющегося в биологической системе количества вещества выделяется за каждую единицу времени; t – текущее время выделения.
Следует сказать, что накопления и выделения ксенобиотиков довольно стабильны, то есть являются величинами статическими, а их определение должно проводиться с учетом возможного влияния биологических процессов, происходящих в организме.
3.5. Факторы, модифицирующие хемобиокинетику
Кинетические закономерности прохождения ксенобиотиков через организм могут изменяться, как правило, количественно в зависимости от многих условий. Классификация факторов, модифицирующих токсикокинетику, представлена в таблице 3.1. Понятно, что эта таблица может быть дополнена. Однако она позволяет в достаточной степени ориентироваться в возможных влияниях на течение кинетических процессов с ксенобиотиками в организме. В случае действия нескольких факторов одновременно картина их влияния может быть весьма сложной [22].
Таблица 3.1. Классификация факторов,
модифицирующих токсикокинетику
| Название группы | Факторы, входящие в группу |
| 1 | 2 |
| Факторы, связанные с биологическим объектом | Индивидуальные особенности (генотип, фенотип) Время Пол Масса тела Видовые особенности Этнический фактор |
| Физиологические факторы | Пища Физическая нагрузка Сон и положение тела Стресс Гемодинамические факторы Беременность и роды Лактация, яйценоскость кур и др. Циркадные ритмы |
Окончание табл. 3.1
| 1 | 2 |
| Патологические состояния | Патология печени, почек, сердечно-сосудистая Инфекция, воспаление, лихорадка Заболевания эндокринной системы Метаболические нарушения Кистозный фиброз Онкологические заболевания Ожог Алкоголизм, наркомания |
| Факторы, связанные с окружающей средой | Время года Температура Давление кислорода |
| Факторы, связанные с формой поступления ксенобиотика в организм | Величина дозы, концентрация Режим поступления в организм Путь поступления в организм Форма поступления |
| Взаимодействие ксенобиотиков в организме | Комплексоны Курение Алкоголь Различные загрязнители Лекарства и др. |
| Структура вещества и их физико-химические свойства | Гомологи Изомеры Энантиомеры Радикалы и др. |
ГЛАВА 4. ОСНОВЫ ТОКСИКОМЕТРИИ
4.1. Основные параметры токсичности веществ,
нормирование класса опасности
Изучение любого вредного вещества предусматривает установление количественных показателей его токсичности и опасности, то есть показателей токсикометрии. Токсикометрия представляет собой совокупность, систему принципов, методов и приемов оценки токсичности и опасности химических веществ. При этом под опасностью понимают вероятность проявления химическим веществом своих токсических свойств в определенных условиях.
Любая оценка токсичности вещества, его опасности для организма складывается из двух независимых и равных по своему значению составляющих: экспозиции и токсичности. Следует сказать, что каждая из них сама по себе не дает возможности оценить воздействие химического вещества на организм.
Экспозиция – это концентрация вредного вещества, которая воздействует на человека, животное или растение в течение определенного времени. Основной мерой экспозиции является доза– количество вещества, которое воздействует на организм при ингаляции загрязненного воздуха, поглощении загрязненной воды или пищи, контакте кожи с ним.
Оценка экспозиции заключается в определении того, какими путями, через какие компоненты окружающей среды, на каком количественном уровне (выраженном как концентрация в этом компоненте и/или как доза), в какое время, при какой периодичности и общей продолжительности имеет место реальное или ожидаемое воздействие конкретного вредного вещества на человеческую популяцию или ее часть с учетом численности.
Токсичность – способность веществ нарушать физиологические функции организма, что, в свою очередь, приводит к заболеваниям или летальному исходу.
Количественная характеристика токсических свойств веществ основывается на фундаментальном представлении о яде как субстанции количественной.
Базовым показателем среди количественных характеристик токсичности является смертельный эффект и его зависимость от токсической дозы.
Токсическая доза – количество вещества, отнесенное, как правило, к единице массы животного или человека, вызывающее определенный токсический эффект. Чем меньше токсическая доза, тем выше токсичность вещества.
Все дозы или концентрации ядов, вызывающие тот или иной токсический эффект при воздействии на организм, условно делят на смертельные дозы LD или смертельные концентрации CD; несмертельные дозы ED или несмертельные концентрации EC.
Смертельная доза – это количество вещества, находящееся во вдыхаемом воздухе, вызвавшее гибель животного.
Критериями оценки смертельных эффектов являются: LD0, LD16, LD50, LD84, LD100.
0 – нет гибели животных в эксперименте;
16 – 16% животных погибло в эксперименте;
50 – погибла половина животных;
84 – 84% животных погибло в эксперименте;
100 – погибли все животные.
Средняя смертельная доза выражается в единицах массы вещества, отнесенных к единице массы тела подопытного животного (г/кг). При помощи средней смертельной дозы LD50 оценивают абсолютную ядовитость вещества при внутрижелудочном, внутрибрюшинном, внутривенном, внутримышечном путях введения. В отдельных случаях среднесмертельные дозы LD50 могут быть отнесены к единице поверхности, например кожи (мг/см2).
Средняя смертельная концентрация LC50 используется при оценке ингаляционных отравлений, а также в тех случаях, когда необходимо охарактеризовать ядовитость растворов вредных веществ. В качестве единиц измерения концентрации используется отношение количества вещества к единице объема (г/м3, мг/дм3, % и т. д.).
Если величины смертельных доз и концентраций рассматриваются как показатели абсолютной токсичности яда, то в качестве показателя ядовитости (токсичности) используется величина, обратная LD50, LС50, то есть 1/ LD50, 1/ LС50.
Практическая направленность профилактической токсикологии обуславливает необходимость экспериментального обоснования гигиенических параметров и нормативов, положенных в основу создания системы показателей опасности. Система показателей опасности наиболее обстоятельно разработана в промышленной токсикологии (ГОСТ 12.1.1.007–76). В зависимости от величины показателей опасности устанавливают класс опасности вредного вещества. Конкретно к показателям опасности относятся:
1. Предельно допустимая концентрация вредного вещества в воздухе рабочей зоны (ПДКраб. з) – концентрация, которая при ежедневной (кроме выходных дней) работе по 8 ч и не более 40 ч в неделю в течение всего рабочего стажа не должна вызывать заболеваний или отклонений в состоянии здоровья, обнаруживаемых современными методами исследований в процессе работы или в отдаленные сроки жизни настоящего и последующего поколений.
2. Средняя смертельная доза при введении в желудок (LD50 в жел) – доза вещества, вызывающая гибель 50% животных при однократном введении в желудок.
3. Средняя смертельная концентрация в воздухе (LС50) – концентрация вещества, вызывающая гибель 50% животных при ингаляционном воздействии в течение 2–4 ч.
4. Средняя смертельная доза при нанесении на кожу (LD50 НК) – доза вещества, вызывающая гибель 50% животных при однократном нанесении на кожу.
5. Коэффициент возможности ингаляционного отравления (КВИО) – отношение максимально достижимой концентрации вредного вещества в воздухе при 20°С к средней смертельной концентрации вещества для мышей.
6. Коэффициент опасного, внезапного, острого ингаляционного отравления (КОВОИО) – отношение максимально достижимой концентрации вредного вещества в воздухе при 20°С к средней смертельной концентрации вещества с поправкой на коэффициент распределения вредного вещества между кровью и воздухом.
7. Порог однократного (острого) действия (Limас) – минимальная концентрация (доза), вызывающая при однократном воздействии изменение состояния жизнедеятельности организма.
8. Порог хронического действия (Limсh) – минимальная концентрация (доза) вызывающая изменение состояния жизнедеятельности организма при хроническом воздействии.
9. Зона острого действия (Zac) – отношение средней смертельной концентрации вредного вещества к минимальной (пороговой) концентрации (Сmin), вызывающей при однократном ингаляционном воздействии изменение биологических показателей на уровне целостного организма, выходящих за пределы приспособительных физиологических реакций:
Zac = LC50/Сmin .
Чем уже зона и меньше величина Сmin, тем больше возможность острого отравления, и наоборот.
10. Зона хронического отравления (Zch) – отношение минимальной (пороговой) концентрации, вызывающей изменение биологических показателей на уровне целостного организма, выходящих за пределы приспособительных физиологических реакций, к минимальной (пороговой) концентрации, вызывающей вредное воздействие в хроническом эксперименте по 4 ч пять раз в неделю на протяжении не менее 4 мес.
Класс опасности вредных веществ устанавливают в зависимости от норм и показателей, указанных в табл. 4.1.
При оценке опасности для одного и того же вещества по ряду показателей можно получить разные классы, но определяющим должен быть показатель, значение которого соответствует наиболее высокому классу опасности.
Таблица 4.1. Нормы для класса опасности
| Показатель | Класс опасности | |||
| 1 | 2 | 3 | 4 | 5 |
| ПДК вредных веществ в воздухе рабочей зоны, мг/м3 | Менее 0,1 | 0,1–1,0 | 1,1–10,0 | Более 10,0 |
| Средняя смертельная доза при введении в желудок, мг/кг | Менее 15 | 15–150 | 151–5000 | Более 5000 |
| Средняя смертельная доза при нанесении на кожу, мг/кг | Менее 100 | 100–500 | 501–2500 | Более 2500 |
Дата добавления: 2016-02-13; просмотров: 2500;
