Теоретические основы. Параметры состояния и газовые законы
Параметры состояния и газовые законы
Состояние любого вещества принято характеризовать рядом величин, которые в термодинамике называются параметрами состояния. Чаще всего состояние тела определяется следующими параметрами: удельным объемом u, давлением Р и температурой Т.
Уравнение состояния идеального газа (уравнение Клапейрона) Связывает между собой все указанные выше параметры (Р, u, Т) и имеет вид:
для 1 кг, Рu = RT,
для G кг, РV = GRT,
для 1 кмоля, Pu = 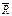 T,
T,
для G кмолей, PV = 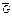
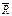 T, (3.1.1)
T, (3.1.1)
где Р – абсолютное давление газа, Пa; u - удельный объем газа, м3/кг; R – газовая постоянная для 1 кг газа, Дж/(кгК); Т - абсолютная температура газа, К,
Т = 273,2 + t;
V – объем газа, м3; G - масса газа, кг; 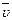 = mu - удельный объем 1 кмоля газа, м3/кмоль,
= mu - удельный объем 1 кмоля газа, м3/кмоль,
u = mu;
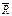 = mR – универсальная газовая постоянная газа, Дж/кмоль∙К;
= mR – универсальная газовая постоянная газа, Дж/кмоль∙К; 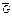 – число кмолей газа в объеме; m - масса 1 кмоля газа в кг (численно равная молекулярной массе газа).
– число кмолей газа в объеме; m - масса 1 кмоля газа в кг (численно равная молекулярной массе газа).
Следует особо отметить, что в уравнении состояния входит только абсолютное давление.
Абсолютное давление определяется из отношения
Рабс=Рман+ В,
где Рман - давление газа по манометру; B – атмосферное (барометрическое) давление.
Кроме того, при решении практических задач пользуются следующими законами идеальных газов:
Закон Бойля – Мариотта – устанавливает зависимость давления и удельного объема газа при постоянной температуре (Т – idem)
Р1υ1= Р2 υ2 или 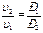
Закон Гей–Люссака при постоянном давлении (P – idem) объем газа при нагревании изменяется прямопропорционально повышению температуры
υ = υ0 (1 + αt),
где υ – удельный объем при температуре t 0C,υ0 - удельный объем газа при температуре t =0C,α -температурный коэффициент объемного расширения идеальных газов при t = 0 0Cодинаковый для различных газов и сохраняющий одно и тоже значение α=1/273,16 1/К.
Или этот закон можно записать в виде:
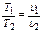 .
.
Дата добавления: 2016-02-27; просмотров: 1002;
