Примеры решения задач. Пример 3.1.1. Баллон с метаном емкостью 100 л находится под давлением 10 МПа при t = 15°С
Пример 3.1.1. Баллон с метаном емкостью 100 л находится под давлением 10 МПа при t = 15°С. После израсходования части метана давление понизилось до 7 МПа, а температура упала до t = 10°С. Определить массу израсходованного газа.
Решение
Из уравнения состояния PV = GRT находим, что до расходования метана его масса в баллоне была равна
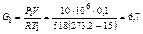 кг;
кг;
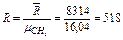 Дж/(кг∙К).
Дж/(кг∙К).
После израсходования части газа масса метана в баллоне будет равна
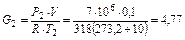 кг.
кг.
Следовательно, расход метана составит
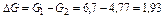 кг.
кг.
Пример 3.1.2. Определить удельный объем пропана как идеального газа при следующих условиях: температура газа t = 20°С, манометрическое (избыточное) давление газа в баллоне 5,6 МПа. Абсолютное давление газа в помещении равно
В = 0,099 МПа= 99,0 кПа.
Решение
Абсолютное давление газа в баллоне

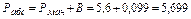 МПа.
МПа.
Удельная газовая постоянная пропана
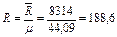 Дж/(кг∙К).
Дж/(кг∙К).
Абсолютная температура газа
Т = 273,2 + 20 - 293,2 К.
Удельный объем пропана в рассматриваемых условиях
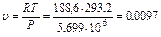 м3/кг.
м3/кг.
Удельный молярный объем пропана при тех же условиях равен
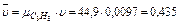 м3/кмоль,
м3/кмоль,
или, что то же самое,
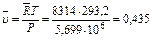 м3/кмоль.
м3/кмоль.
Пример 3.1.3. Газ при давлении 5 ат (Р1) занимает объем, равный 60 м3 (V1). Какой объем займет газ при 15 ат (Р2) и той же температуре?
Решение
Согласно закону Бойля-Мариотта при Т=const P2V2=P1V1
Следовательно:
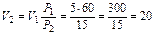 м3.
м3.
Пример 3.1.4. Коксовый газ, образовавшийся в камере коксовой печи, охладился с 1000 до 500С. Во сколько раз уменьшился объем коксового газа, если давление его не изменилось?
Решение
Исходя из закона Гей-Люссака при P=const можно записать
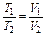
Откуда, принимая конечный объем за 1, получим
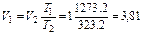 раза.
раза.
Пример 3.1.5. Под давлением 100 кПа и при температуре 1230С находится 4,2 кг метана. Какой объем занимает метан?
Решение
Для G кг газа по уравнению Клапейрона-Менделеева получим:
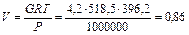 м3;
м3;
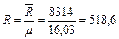 Дж/кг∙К,
Дж/кг∙К,
где 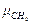 =16,03.
=16,03.
Дата добавления: 2016-02-27; просмотров: 4183;
