Основные химические вещества пищи.
Белки. Роль белков в питании и технологии пищевых производств.
Белками и белковыми веществами называются высоко молекулярные природные полимерные молекулы, которые построены из остатков аминокислот. Каждый белок обладает своей, присущей только ему, последовательностью расположенных аминокислотных остатков.
Белки являются важнейшей составной частью пищи человека и поставщиком необходимых организму аминокислот. По назначению в организме различают белки, выполняющие роль строительного материала (коллагены, кератины, соединительные). Белки выполняют двигательные функции (миозин, акцин). Транспортные белки (гемоглобин). Белки используют непосредственно для питания (козеин молока и альбумин яиц).
Строение. Физические и химические свойства аминокислот и белков.
Свойства белков.
Белки — амфотерные электролиты. При определенном рН среды (изоэлектрическая точка) число положительных и отрицательных зарядов в молекуле белка одинаково. Это одна из основных констант белка. Белки в этой точке электронейтральны, а их вязкость и растворимость наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул широко используется для выделения их из растворов, например в технологии получения белковых продуктов.
Гидратация.Белки связывают воду, т. е. проявляют гидрофильные свойства. При этом они набухают, увеличивается их масса и объем. Набухание белка сопровождается его частичным растворением. Гидрофильность отдельных белков зависит от их строения. Имеющиеся в составе и расположённые на поверхности белковой макромолекулы гидрофильные СО—NН (пептидная связь), аминные NH 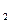
 и карбоксильные СООН группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы.
и карбоксильные СООН группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы.
Окружающая белковые глобулы гидратная (водная) оболочка препятствует агрегации, а следовательно, способствует устойчивости растворов белка и препятствует его осаждению.
В изоэлектрической точке белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например этилового спирта. Это приводит к выпадению их в осадок. При изменении рН среды макромолекула белка становится заряженной, и его гидратационная способность меняется. При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не обладают текучестью, они упруги, обладают пластичностью, определенной механической прочностью, способны сохранять свою форму. Глобулярные белки могут полностью гидратироваться, растворяясь в воде (например, белки молока, образуя растворы с невысокой концентрацией).
Гидрофильные свойства белков, т. е. их способность набухать, образовывать студни, стабилизировать суспензии, эмульсии и пены имеют большое значение в биологии и пищевой промышленности. Очень подвижным студнем, построенным в основном из молекул белка, является цитоплазма — полужидкое содержимое клетки. Сильно гидратированный студень — сырая клейковина, выделенная из пшеничного теста, она содержит до 65 % воды. Различная гидрофильность клейковинных белков — один из признаков, характеризующих качество зерна пшеницы и получаемой из него муки (так называемые сильные и слабые пшеницы). Гидрофильность белков зерна и муки играет большую роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, при изготовлении мучных кондитерских изделий, представляет собой набухший в воде белок, концентрированный студень, содержащий зерна крахмала.
Денатурация.Денатурация белков — сложный процесс, при котором под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и ряда других факторов) происходит изменение вторичной, третичной и четвертичной структуры белковой макромолекулы, т. е. ее нативной пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются. При денатурации изменяются физические свойства белка, снижается растворимость, способность к гидратации, теряется его биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых химических групп, облегчается воздействие на белки протеолитических ферментов, а следовательно, он легче гидролизуется.
В пищевой технологии особое практическое значение имеет тепловая денатурация белков. Степень тепловой денатурации белков зависит от температуры, продолжительности нагрева и влажности. Это необходимо помнить при разработке режимов термообработки пищевого сырья, полуфабрикатов, а иногда и готовых продуктов. Особую роль процессы тепловой денатурации играют при бланшировании растительного сырья, сушке зерна, выпечке хлеба, получении макаронных изделий.
Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). Наконец, к денатурации белков приводит действие химических реагентов (кислоты, щелочи, спирт, ацетон). Все эти приемы широко используют в пищевой и биотехнологии.
Пенообразование.Под этим процессом понимают способность белков образовывать высококонцентрированные системы жидкость — газ. Такие системы называют пенами. Устойчивость пены, в которой белок является пенообразователем, зависит не только от его природы, но и от концентрации, а также от температуры. Белки в качестве пенообразователей широко используются в кондитерской промышленности (пастила, зефир, суфле). Структуру пены имеет хлеб, и это влияет на его органолептичеуские свойства. Молекула белков под влиянием ряда факторов может разрушаться или вступать во взаимодействие с другими X веществами с образованием новых продуктов. Для пищевой промышленности можно выделить два очень важных процесса гидролиз белков под действием ферментов и взаимодействие аминогрупп белков или аминокислот с карбонильными группами восстанавливающих Сахаров (реакция меланоидинообразования, см. раздел «Углеводы»). Под влиянием протеаз — I ферментов, катализирующих гидролитическое расщепление белков, последние распадаются на более простые продукты (поли- и I дипептиды) и в конечном итоге на аминокислоты. Скорость гидролиза белка зависит от его состава, молекулярной структуры, активности фермента и условий. Частичный гидролиз белка мы наблюдаем при тестоведении, получении ряда мясных и молочных продуктов.
Дата добавления: 2016-02-24; просмотров: 1428;
