Понятие о химическом равновесии. Закон действующих масс.
Многие химические реакции протекают так, что взятые вещества целиком превращаются при данных условиях в конечные продукты реакции, т. е. процесс идет до конца. Эти реакции называются необратимыми. Примером такой реакции может служить взаимодействие металлического цинка с раствором серной кислоты:
Zn + H2SO4 = Zn SO4 +H2↑
Однако при очень многих химических превращениях процессы могут протекать как в прямом, так и в обратном направлениях. Такие реакции называют обратимыми. Так, в замкнутом сосуде при температуре 773 К и давлении в 30 МПа между эквивалентными количествами азота и водорода будет идти реакция
N2 + 3H2→ NH3
Аммиак по мере его накопления будет разлагаться:
2NH3→ N2+3H2
Таким образом, реакция между азотом и водородом протекает обратимо, поэтому при записи ее в виде уравнения вместо знака равенства обычно ставят знак обратимости:
N2 + 3H2  2NH3
2NH3
Реакция, идущая слева направо, называется прямой, а идущая справа налево — обратной.
Если по ходу реакции измерять концентрации участвующих в ней веществ, можно выявить следующие закономерности. В начале реакции концентрация азота и водорода уменьшается, а концентрация аммиака возрастает, т. е. идет прямая реакция. По мере же увеличения количества аммиака начинает преобладать обратная реакция, т. е. его разложение до исходных продуктов — азота и водорода. В начальный момент реакции, когда концентрации исходных веществ велики, скорость прямой реакции будет наибольшей, затем она постепенно уменьшается. По мере увеличения концентрации продуктов реакции скорость обратного процесса будет пропорционально увеличиваться. Наконец, через некоторое время наступит такое состояние, когда скорости прямой и обратной реакции станут равными. В этом случае в сосуде будут находиться в определенном количественном соотношении все три компонента рассматриваемой химической системы. И сколько бы мы ни выдерживали данную систему при вышеуказанных условиях, концентрация аммиака, водорода и азота останется неизменной, причем аммиака будет 26,4 об. доли в %, а водорода и азота — 73,6 об. доли в %. Иными словами, система при данных условиях находится в состоянии равновесия.
Необходимо отметить, что химическое равновесие следует понимать не как состояние покоя, а как процесс, идущий беспрерывно с одинаковой скоростью в обоих направлениях. При этом концентрации веществ не меняются, что и создает видимость покоя. Такое состояние называется химическим динамическим равновесием.
Обратимые химические реакции были изучены русским ученым Н. Н. Бекетовым (1865), который установил влияние концентрации реагирующих веществ на направление и скорость химического процесса. В частности, наблюдая действие газообразного водорода на соли и оксиды некоторых металлов, он пришел к выводу, что вытесняющее и восстанавливающее действие водорода зависит от давления, под которым находится газ, т. е. от массы водорода. Таким образом, Бекетов вплотную подошел к формулировке закона действующих масс.
Эта формулировка в более общей форме была дана позднее Гульдбергом и Вааге (1867): скорость химической реакции пропорциональна действующим массам. Под действующими массами понимаются молярные концентрации веществ, участвующих в реакциях.
Если обозначить концентрации веществ А и В через [А] и [В], то скорость химической реакции согласно закону действующих масс можно записать уравнением
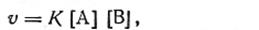
| 2.35 |
где К—константа скорости химической реакции, показывающая, какая доля исходных веществ реагирует в единицу времени.
Очень часто встречаются такие реакции, в которых в элементарном акте участвует несколько молекул одного и того же вещества, например
mA+nB= pAB
В этом случае скорость реакции выразится общей формулой
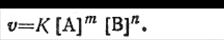
| 2.36 |
Как видим, в приведенном варианте концентрация входит в уравнение скорости в степени, разной числовому коэффициенту химического уравнения реакции. Таким образом, уравнения (2.35) и (2.36) являются математическим выражением закона действующих масс.
Количественная характеристика состояния динамического химического равновесия может быть выражена через так называемую константу химического равновесия, которая легко может быть выведена из следующих рассуждений. Для обратимой химической реакции типа
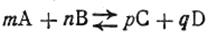
скорость прямой реакции согласно закону действующих масс
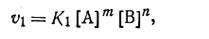
| 2.37 |
а скорость обратной реакции
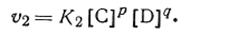
| 2.38 |
В момент химического равновесия υ1 =υ2,т. е.
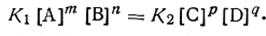
| 2.39 |
Преобразовав уравнение (2.39), можно написать для любой химической реакции, протекающей в растворах или в газообразной среде, выражение константы равновесия
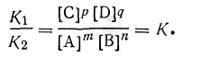
| 2.40 |
Таким образом, константа химического равновесия К есть величина, численно равная отношению произведения действующих масс продуктов реакции к произведению действующих масс исходных реагирующих веществ. Причем стехиометрические коэффициенты являются показателями степени при соответствующих действующих массах.
Константа химического равновесия является характерной для, каждой химической реакции величиной. Она, как показывает опыт, не зависит от концентрации реагирующих веществ, но изменяется с температурой.
Поскольку константа химического равновесия, как следует из уравнения (2.40), равна отношению констант скоростей прямой и обратной реакций, она показывает, во сколько раз прямая реакция идет быстрее обратной при данных условиях и при данном произведении концентраций реагирующих веществ, равном единице. Если K>1, то быстрее идет прямая реакция, и, наоборот, если К<1, быстрее идет обратная реакция.
Так, если величина К равна 107, это означает, что при данных условиях прямая реакция идет в 10 млн. раз быстрее, чем обратная, если же К равно 10-5, обратная реакция идет в 100 тыс. раз быстрее, чем прямая, и т. д. Ниже приводятся константы некоторых равновесных систем:
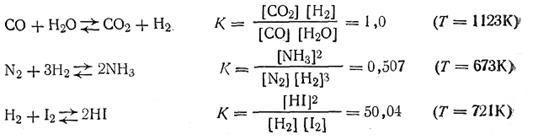
Если в реакции участвуют газообразные вещества, в выражение константы равновесия (2.40) можно ввести вместо концентраций парциальные давления. Так, для гомогенной газовой химической реакции типа
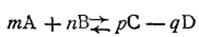
где т, п, р, q — стехиометрические коэффициенты, уравнение (2.40) можно записать в следующем виде:
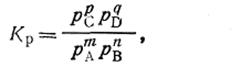
| 2.41 |
где р — парциальное давление вещества; Kр — константа равновесия, выраженная через парциальные давления.
Знание размера константы химического равновесия позволяет производить очень важные расчеты: по известным концентрациям взятых веществ можно вычислить равновесные концентрации продуктов реакции и, таким образом, судить об эффективности процесса при данных условиях.
Дата добавления: 2016-02-20; просмотров: 1641;
