Ферменты как катализаторы. Кинетика биохимических реакций. Уравнение Михаэлиса – Ментен.
В процессе жизнедеятельности в любом живом организме совершаются сложнейшие и многообразные превращения химических веществ различной природы. Подавляющее большинство, а по некоторым данным даже все химические реакции в живых организмах протекают с участием биологических катализаторов — ферментов. Этим и объясняется легкость прохождения этих реакций.
Ферментативный катализ существенно отличается от химического катализа. Эти отличия сводятся к следующему.
Каталитическая активность. По активности биологические катализаторы в миллионы раз превосходят активность химических катализаторов. Даже лучший из неорганических катализаторов — атомная платина — уступает, например, ферменту каталазе по активности в расчете на 1 активный центр в тысячи раз. О скорости ферментативных реакций можно судить по следующему примеру: 1 моль фермента сахарозы способен расщепить в 1 с 1000 моль свекловичного сахара.
Ничтожно малые количества ферментов способны расщеплять огромные количества реагирующих веществ. Так, 1 г кристаллического пепсина расщепляет 50 кг коагулированного яичного белка, а 1 г кристаллического ренина свертывает 72 т молока. Фермент пероксидаза, который ускоряет окисление субстрата за счет пероксида водорода, проявляет свою активность при разбавлении 1 мас. ч. фермента в 500 000 000 мас. ч. воды.
Согласно рекомендации международной комиссии по номенклатуре ферментов каталитическая активность фермента может быть охарактеризована его «молекулярной активностью», под которой следует понимать число молекул данного субстрата или эквивалентов затронутых групп, превращаемых за 1 мин одной молекулой фермента при оптимальной концентрации субстрата.
Высокая химическая специфичность. В отличие от химических катализаторов ферменты обладают значительно большей специфичностью: каждый из них действует лишь на строго определенную реакцию или группу реакций, протекающих в организме. Предполагается, что в организме человека одновременно функционирует около 1000 различных ферментов. При этом они образуют сложные ферментативные системы, которые обеспечивают в живой клетке протекание целого ряда строго последовательных и согласованных между собой реакций. Если бы ферменты не обладали столь высокой специфичностью, это привело бы к быстрому распаду всех веществ в клетках и к гибели всего организма.
Специфичность ферментов подразделяется на абсолютную (или химическую) и стереохимическую.
Абсолютная специфичность — это действие каждого фермента на вещество строго определенного химического состава. Например, фермент уреаза катализирует только гидролиз мочевины, фермент пепсин — только расцепление белков, каталаза действует лишь на пероксид водорода.
Стереохимическая специфичность заключается в том, что ферменты действуют только на определенные стереоизомеры органических соединений. В качестве примера подобной специфичности можно указать на действие двух ферментов: α- и β-глюкозидазы. Фермент α-глюкозидаза действует только на α-глюкозиды, а β-глюкозидаза — на β-глюкозиды, что хорошо видно на приведенной схеме:

Причины столь высокой специфичности ферментов еще до конца не изучены. Существует целый ряд теорий, объясняющих механизм действия ферментов.
Так, немецкий химик Фишер для объяснения специфичности фермента по отношению к данному субстрату в свое время предложил гипотезу «замка и ключа». Согласно этой гипотезе молекула субстрата точно соответствует по своей форме некоторому участку на молекуле фермента. Фишер полагал, что «ключ» — субстрат точно подходит к ферменту — «замку» без какого бы то ни было нарушения формы обеих молекул. Однако, как показали исследования, в ряде случаев гипотеза Фишера не может объяснить некоторые факты.
Для того чтобы привести эту теорию в соответствие с опытными данными, Кошланд несколько видоизменил модель «ключ — замок». Согласно его гипотезе субстрат, присоединяясь к активному центру, изменяет его форму, обеспечивая таким образом идеальное их соответствие. Иными словами, функциональные группы в активном центре принимают специфическую пространственную конфигурацию только тогда, когда их вынуждает к этому присутствие субстрата.
Так, образование фермент-субстратного комплекса может происходить за счет электрически заряженных группировок как на ферменте, так и на субстрате. Такими группировками могут быть

В результате подобного взаимодействия в субстрате могут происходить определенные химические изменения, выражающиеся в образовании новых функциональных групп с совершенно иными полярными свойствами. После реакции фермент и субстрат как бы отталкиваются друг от друга, и фермент вновь готов вступить во взаимодействие с другой молекулой субстрата. Химически измененный субстрат отщепляет продукт реакции.
Таким образом, специфичность фермента обусловливается его конфигурацией, строением и электрическими свойствами активной группы фермента.
Инактивация.Впроцессе протекания каталитической реакции фермент постепенно разрушается и утрачивает свою активность. Это явление получило название инактивации. Опыт показывает: чем большей активностью обладает фермент, тем он сильнее разрушается в процессе катализа. Этим свойством ферменты существенно отличаются от неорганических катализаторов, которые, как уже отмечалось, остаются без изменения в продуктах реакции.
Строение ферментов.По сравнению с неорганическими катализаторами ферменты имеют значительно более сложное строение. Каждый фермент содержит белок, которым и обусловлена высокая специфичность биологических катализаторов. По своему строению ферменты подразделяются на два больших класса: однокомпонентные и двухкомпонентные. К однокомпонентным относятся ферменты, состоящие только из белковых тел, которые обладают каталитическими свойствами. У этих ферментов роль активных групп выполняют определенные химические группировки, входящие в состав белковой молекулы и получившие название активных центров.
В настоящее время свыше 100 известных однокомпонентных ферментов по
лучено вкристаллическом виде.
К двухкомпонентным относятся такие ферменты, которые состоят из белковой и небелковой части, называемой простетической группой. Было предложено активную простетическую группу называть агон, а белковый носитель — ферон или иначе апофермент. Исследования показали, что белковая часть двухкомпонентного фермента (ферон) оказывает решающее влияние на специфичность его действия. Вместе с тем соединение активной группы с белком приводит к огромному возрастанию ее каталитической активности.
Было также показано, что прочность связи агона и ферона у разных ферментов различна. У некоторых ферментов, например дегидрогеназ, катализирующих окисление различных субстратов путем отнятия водорода (дегидрирование), эта связь является непрочной. Такие ферменты легко диссоциируют и распадаются на агон и ферон. По предложению выдающегося французского биохимика Г. Бертрана, агоны, легко отделяющиеся от белковой части фермента, обычно называют, коферментами.
В качестве примера двухкомпонентного фермента можно назвать фермент пируватдекарбоксилаза, который расщепляет пировиноградную кислоту на уксусный альдегид и оксид углерода (IV):
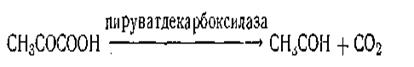
 Химическая природа активной группы пируватдекарбоксилазы в настоящее время полностью выяснена. Она представляет собой соединение молекулы витамина B1 и двух остатков фосфорной кислоты. Пируватдекарбоксилаза является примером фермента, активная группа которого содержит витамин. Как показали исследования, витамины являются неотъемлемой составной частью целого ряда важнейших ферментов (каталаза, пероксидаза и др.).
Химическая природа активной группы пируватдекарбоксилазы в настоящее время полностью выяснена. Она представляет собой соединение молекулы витамина B1 и двух остатков фосфорной кислоты. Пируватдекарбоксилаза является примером фермента, активная группа которого содержит витамин. Как показали исследования, витамины являются неотъемлемой составной частью целого ряда важнейших ферментов (каталаза, пероксидаза и др.).
Влияние внешних условий. По своей природе ферменты значительно более чувствительны к изменению внешних условий, чем неорганические катализаторы. В частности, ферменты «работают» в значительно более узком диапазоне температур. Температурный оптимум большинства растительных ферментов 313—333 К, животных ферментов 313—323 К. Если температура превысит эти пределы, активность фермента очень быстро падает, а при 343—353 К происходит их необратимое разрушение, обусловленное денатурацией белка. Лишь очень немногие ферменты способны в определенных условиях выдержать нагревание до 373 К без потери активности.
Неорганические катализаторы, как показывает опыт, могут отлично работать и при более высоких температурах — до нескольких сот градусов.
В отличие от неорганических катализаторов ферменты проявляют свою активность в строго определенном диапазоне значений рН среды. В табл. 2.1 приведены значения рН, при которых различные ферменты проявляют свою максимальную активность.
Как видно из этой таблицы, диапазон значений рН весьма широк для активности различных ферментов. Влияние рН на активность ферментов объясняется изменением состояния ионизации не только фермента и субстрата в отдельности, но и фермент – субстратного комплекса.
Различные ферменты имеют различный оптимум pH.
Ферменты разных с/х культур имеют разные оптимальные значения pH:
У риса 4,5 < pH optim < 5,5
У пшеницы 6,0 < pH optim < 7,0
В общем виде: Vкат. = f (T,pH)
Кинетика биохимических реакций описывается уравнением Михаэлиса – Ментен. Михаэлис и Ментен изучали скорость реакции гидролиза АТФ миозином. Белки актин, миозин и АТФ играют определяющую роль в процессе мышечных сокращений.
АТФ гидролиз→ АДФ + Ф + Е
Е – эта энергия используется при мышечных сокращениях.
АТФ – субстрат (реагент);
Миозин – катализатор.
υ0 = υ0 max ∙ S0 / KS + S0 2.31а
где υ0 – начальная скорость реакции;
υ0 max – теоретически определенная начальная скорость реакции при max концентрации субстрата;
S0 – начальная концентрация субстрата;
KS – такая концентрация субстрата, при которой: υ0 = ½ υ0 max

1) при малых S0 зависимость υ0 = f (S0) линейна (подчиняется уравнению реакции Ι – го порядка);
2) при S0 » KS реакция нулевого порядка относительно концентрации субстрата, т. е. начальная скорость не зависит от концентрации субстрата, наступает насыщение.
Дата добавления: 2016-02-20; просмотров: 2612;
