ИНГИБИТОРЫ АНГИОТЕНЗИНПРЕВРАЩАЮЩЕГО ФЕРМЕНТА
Ингибиторы ангиотензинпревращающего фермента (иАПФ) подавляют ключевой фермент РАС, связывая ионы цинка в его активном центре. Ингибиторы АПФ блокируют прессорные механизмы и активируют депрессорные механизмы регуляции АД.
Первая реакция в каскаде образования ангиотензина II - превращение ангиотензиногена в ангиотензин I при участии протеолитического фермента ренина (рис. 39-1).
Ренин (от лат. ren - почка) открыли шведские ученые. В 1897 г. уроженец шведской части Финляндии профессор физиологии Каролингского института в Стокгольме Роберт Тигерштедт готовился к выступлению на XII съезде врачей в Москве. По его заданию студент-медик Пер Густав Бергман изучал эффекты экстракта почек кролика. При введении этого экстракта другому кролику через 15 мин значительно повышалось АД. Гипертензивное действие было особенно выражено после нефрэктомии. Эксперименты Тигерштедта отличались совершенной техникой исполнения, их проводили в асептических условиях. У других исследователей подобные эксперименты не получались, так как экстракт почек подвергался бактериальному загрязнению с разрушением гипертензивного фактора.
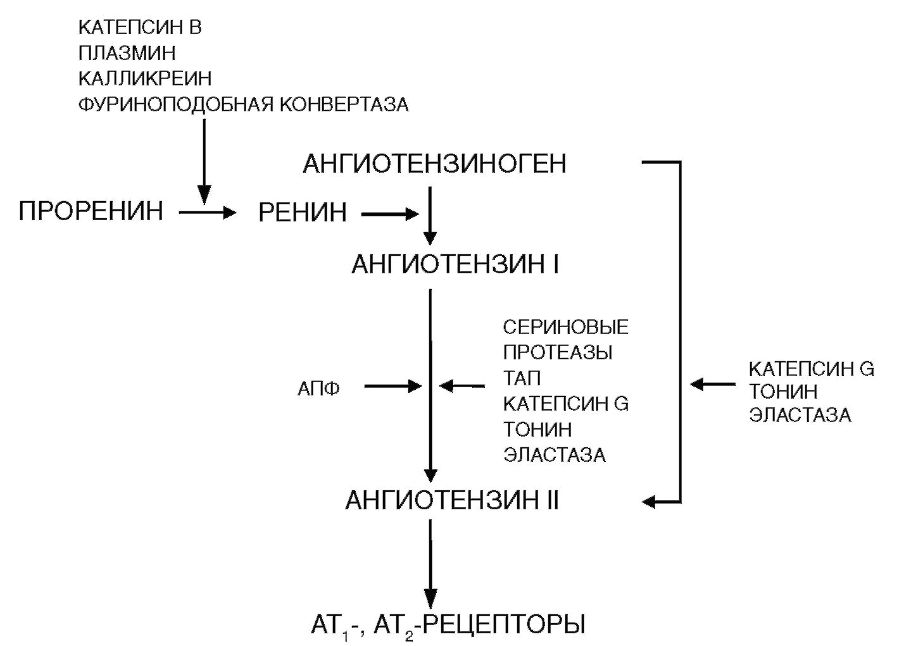
Рис. 39-1.Ренин-ангиотензиновая система. ТАП - тканевый активатор плаз-миногена
Спустя 30 лет канадский ученый Гарри Голдблатт установил, что действующим веществом экстракта почек является протеолитический фермент ренин. В 1935 г. Эдуардо Мендез в Аргентине и Ирвинг Пейдж в США открыли, что после пережатия почечной артерии в крови кроликов появляется низкомолекулярный прессорный агент. Мендез назвал это вещество ангиотонином, Пейдж предложил название «гипертензин». В 1958 г. ученые сравнили результаты своих исследований и поняли, что речь идет об одном и том же соединении. Для его обозначения было придумано химерное название «ангиотензин».
Ренин представляет собой одноцепочечную аспартиловую протеазу с высокой субстратной специфичностью для ангиотензиногена. Ренин синтезируется в виде проренина в ЭПР эпителиоидных клеток юкстагломерулярного аппарата почек (ренинпродуцирующий сегмент приносящей артериолы). Для активации проренина необходимо отщепление блокирующего пептида при участии катепсина В, плазмина, калликреина или фуриноподобной конвертазы. Ренин выделяется из гранул в ответ на снижение АД и недостаточное раздражение барорецепторов в приносящих артериолах, активацию β-адренорецепторов, уменьшение содержания ионов натрия и хлора в клубочковом фильтрате. Секрецию ренина тормозят ангиотензин II, альдостерон, натрийуретические пептиды, эндотелин-1, тромбоксан А2, аденозин. Колебания АД в течение суток (ночное снижение и повышение в утренние часы) совпадают с динамикой активности ренина в крови. В вертикальном положении активность ренина в крови возрастает в 2-4 раза.
При артериальной гипертензии проренин оказывает самостоятельное действие, без отщепления полипептидного фрагмента и превращения в ренин. Взаимодействуя с рецепторами в мезангиоцитах почечных клубочков, нефроцитах дистальных извитых канальцев и собирательных трубочек, кардиомиоцитах, гладких мышцах сосудов, проренин катализирует образование ангиотензина I, активирует трансформирующий фактор роста-β (стимулятор фиброза) и ингибитор тканевого активатора плазминогена-1 (фактор эндотелийзависимого звена гемостаза). Эти метаболические эффекты сопровождаются патологическим ремоделированием миокарда, сосудов и почек. Обычно активность проренина и ренина в крови коррелирует и изменяется параллельно, но при сосудистых осложнениях сахарного диабета, ХСН, синдроме поликистозных яичников, преэклампсии преимущественно повышается активность проренина.
Ангиотензиноген - гликопротеин (а2-глобулин) с молекулярной массой 60 кДа, состоящий из 14 аминокислотных остатков. Образуется преимущественно в печени, а также головном мозге, миокарде и почках. Под влиянием ренина от ангиотензиногена отщепляется декапептид ангиотензин I.
АПФ содержит в активном центре цинк, является трансмембранной эндопептидазой эндотелия сосудов и секретируется в растворимой форме в кровь и ткани. Ген АПФ характеризуется полиморфизмом: в его 16-м интроне присутствует (вариант I) или отсутствует (вариант D) 287-й остаток. У людей, гомозиготных по наличию 287-го остатка (генотип II), активность АПФ в крови ниже, чем при генотипе DD, соответственно, меньше риск повышения АД. Люди с генотипом DD более чувствительны к солевой диете и значительно хуже отвечают на лечение иАПФ, у них выше риск депрессии, инфаркта миокарда, диабетической нефропатии и микроангиопатии.
АПФ катализирует ряд биохимических реакций:
• образование октапептида ангиотензина II из декапептида ангиотензина I (отщепляет от последнего карбоксильный дипептид);
• инактивацию брадикинина (АПФ, участвующий в этой реакции, получил название «кининаза II»);
• инактивацию энкефалинов, β-эндорфина, субстанции Р, АКТГ, рилизинг-фактора лютеинизирующего гормона, β-цепи инсулина.
Ангиотензин II имеет период полуэлиминации 12 мин. При участии аминопептидазы А он трансформируется в ангиотензин III, состоящий из 7 аминокислот. Затем аминопептидаза N превращает ангиотензин III в ангиотензин IV (6 аминокислот). АПФ-2 превращает ангиотензины I и II в ангиотензин-(I-VII). Ангиотензин-(I-VII) активирует митогенактивированные протеинкиназы, участвует в выделении NO и простациклина, тормозит ангиогенез, пролиферацию гладких мышц сосудов, повышает натрийурез, снижает свертывание крови. В итоге ангиотензин-(I-VII) противодействует эффектам ангиотензина II.
В регуляции функций участвуют плазменная (циркулирующая, эндокринная), тканевая (локальная, паракринная) и внутриклеточная РАС. Только 10% ангиотензина II образуется в плазме крови, 90% имеет тканевое происхождение или поступает в ткани в результате захвата из крови. Плазменная РАС способна к моментальной активации и оказывает кратковременное воздействие. Она играет роль скорой помощи при кровотечении, падении АД, инфаркте миокарда. Тканевая РАС находится в легких, сердце, почках, надпочечниках, поджелудочной железе, яичниках, жировой ткани, головном мозге (из этих органов выделены проренин, ренин, АПФ, ангиотензиноген, ангиотензины I и II). Активность тканевой РАС нарастает постепенно, что приводит к длительным и часто необратимым изменениям функций и структуры органов. В эффектах внутриклеточной РАС не участвуют АТ1- и АТ2-рецепторы.
РАС головного мозга регулирует мозговое и периферическое кровообращение, обучение, память, мотивации поведения, питьевой и пищевой инстинкты.
Ангиотензин II активирует метаботропные АТ1- и АТ2-рецепторы. Они состоят из семи трансмембранных доменов и ассоциированы с G-белками.
АТ1-рецепторы локализованы в сердце, артериях, почках, надпочечниках, гипофизе, нервной системе (табл. 39-1). Активируют посредством Gq-белка фосфолипазу C мембран и повышают образование вторичных мессенджеров - ИФ3 и ДАГ. ИФ3 высвобождает ионы кальция из ЭПР, ДАГ активирует протеинкиназу C. В сердце АТ1-рецепторы при участии протеинкиназы С передают сигнал на митогенактивированные протеинкиназы. Комплекс этих ферментов активирует в ядре кардио-миоцитов протоонкогены с усилением синтеза структурных белков и ферментов, а также инициирует апоптоз кардиомиоцитов. Такие механизмы лежат в основе гипертрофии миокарда с последующей систолической дисфункцией.
Таблица 39-1.Эффекты ангиотензина II при активации АТ1-рецепторов в норме и при патологии
| Орган | Эффекты ангиотензина II |
| Сердце | |
| Миокард | Повышение сократимости, гипертрофия, фиброз, апоптоз кардиомиоцитов |
| Коронарные артерии | Сужение |
| Периферические артерии | Сужение с ростом АД; повышение чувствительности барорецепторов; снижение секреции и инактивация NO; ускоренный апоптоз эндотелия; гиперплазия и гипертрофия гладких мышц; пролиферация фибро-бластов |
| Почки | |
| Почечная артерия | Сужение с ухудшением почечного кровотока и фильтрации |
Окончание табл. 39-1
| Орган | Эффекты ангиотензина II |
| Клубочки | Сужение приносящей и выносящей (в большей степени) артериолы, клубочковая гипертензия, повышение проницаемости базальной мембраны для белков, пролиферация мезангиальных клеток и образование в них свободных радикалов кислорода, цитокинов и активаторов продукции фибронектина, коллагена IV типа и других компонентов мезангиального матрикса |
| Дистальные извитые канальцы | Реабсорбция Na+ |
| Юкстагломерулярный аппарат | Торможение секреции ренина |
| Надпочечники | |
| Корковый слой | Секреция альдостерона (с повышением реабсорбции Na+ и секреции K+ в дистальных извитых канальцах и корковом сегменте собирательных трубочек почек) и гидрокортизона |
| Мозговой слой | Секреция катехоламинов |
| Гипофиз | Секреция вазопрессина (АДГ) с повышением реабсорбции воды в собирательных трубочках и сужением сосудов |
| Гипоталамус | Активация центра жажды с повышением потребления жидкости |
| Продолговатый мозг | Активация сосудодвигательного центра |
| Периферические симпатические окончания | Секреция норадреналина |
| Поджелудочная железа | Торможение секреции инсулина в β-клетках, ускорение их апоптоза, фиброз островков |
| Глаза | Регуляция кровотока в увеальном тракте и сетчатке, продукции внутриглазной жидкости. Миграция перицитов микрососудов сетчатки, повышение активности факторов роста эндотелия сосудов, избыточная васкуляризация сетчатки |
АТ1-рецепторы повышают секрецию вазопрессина (АДГ), альдостерона, гидрокортизона, адреналина, выделение норадреналина из симпатических нервных окончаний, тормозят секрецию проренина, ренина и инсулина.
Кроме того, АТ1-рецепторы ассоциированы с тирозинкиназой и фосфорилируют внутриклеточные протеинкиназы; активируют фосфолипазу А2, прямо увеличивают проницаемость кальциевых каналов, ингибируют аденилатциклазу.
АТ2-рецепторы, функционирующие при участии Gj-белков, активируют фосфатазы, продукцию NO, открывают калиевые каналы, снижают кальциевую проводимость мембран. Эти рецепторы расширяют сосуды, улучшают почечный кровоток и фильтрацию, оказывают натрийуретическое действие, тормозят пролиферацию эндотелия, гладких мышц и мезангиальных клеток, снижают гипертрофию кардиомиоцитов, образование межклеточного матрикса, ингибируют коллагеназу. АТ2-рецепторы ЦНС являются антагонистами NMDA-рецепторов, участвуют в регуляции поведения. У здоровых взрослых соотношение рецепторов АТ1 и АТ2 составляет 1:2. В клетках плода АТ2-рецепторов значительно больше, чем клетках взрослых. Возможно, АТ2-рецепторы необходимы для роста и дифференцировки клеток, нейрогенеза в периоде эмбрионального развития. Они участвуют в апоптозе. Их активность возрастает в поврежденных тканях, например в зонах ишемии миокарда. При блокаде АТ1-рецепторов активируются АТ2-рецепторы, что может быть полезным при лечении артериальной гипертензии.
АТ3-рецепторы активируются ангиотензином III. Они повышают секрецию вазопрессина, альдостерона, экспрессию нефротоксических цитокинов, вызывают жажду и спазм сосудов. АТ4-рецепторы селективно взаимодействуют с ангиотензином IV, вызывают зависимое от эндотелия расширение сосудов, увеличивают мозговой и почечный кровоток, участвуют в формировании памяти и познавательной деятельности. Возможно, АТ4-рецепторы представляют собой тирозинкиназу. Нежелательные эффекты активации плазменной РАС:
• сужение артерий и вен (повышение АД, пред- и постнагрузки на сердце);
• учащение сердечных сокращений, аритмия;
• ухудшение коронарного кровотока;
• задержка в организме ионов натрия и воды, гипокалиемия.
Гиперактивность тканевой РАС сопровождается нарушением функций и структуры сердечно-сосудистой системы, почек и других органов. Возникают следующие нарушения:
• гипертрофия мышечных волокон сердца в результате активации протоонкогенов, воздействия катехоламинов, ионов кальция и эндотелина-1;
• пролиферация фибробластов и синтез коллагена в миокарде (повышаются секреция альдостерона, синтез трансформирующего фактора роста-β и фактора роста фибробластов);
• гиперплазия и гипертрофия гладких мышц сосудов (прекапилляр-ных сфинктеров);
• клубочковая гипертензия и гиперфильтрация с последующей гибелью клубочков почек, пролиферация мезангиальных клеток в клубочках, снижение чувствительности почек к натрийуретическим пептидам;
• прогрессирование атеросклероза (усиливаются окислительный стресс, местные воспалительные реакции, рост гладкомышечных клеток и их миграция в интиму сосудов; интима инфильтрируется моноцитами/макрофагами, в этих клетках аккумулируются модифицированные ангиотензином II ЛНП, атеросклеротические бляшки становятся нестабильными);
• снижение секреции и изменение активности инсулина (ангиотензин II тормозит секрецию инсулина, вызывает апоптоз β-клеток и фиброз островков за счет образования свободных радикалов, по конкурентному механизму блокирует рецепторы инсулина с ослаблением пострецепторной передачи сигнала, усиливает митогенные и пролиферативные эффекты инсулина).
Первым иАПФ, использованным в клинической практике (1971), был тепротид - полипептид, выделенный Сергио Ферейро из яда бразильской змеи жарараки (Bothrops gararaca). Тепротид проявил высокую терапевтическую эффективность при артериальной гипертензии, но был пригоден только для внутривенного введения, действовал кратковременно и оказывал многочисленные побочные эффекты.
В 1975 г. в лаборатории фирмы Squibb был синтезирован и изучен каптоприл- синтетический иАПФ для приема внутрь. С 1991 г. каптоприл производят в России под названием «капотен». Первое сообщение о препарате II генерации, получившем название «эналаприл»,было опубликовано в журнале «Nature» в 1980 г. сотрудниками фирмы Merck Sharp & Dohme. В настоящее время в медицинской практике используют около 15 иАПФ (табл. 39-2). Они отличаются по химическому строению (каптоприл и зофеноприл содержат сульфгидрильную группу, многие препараты имеют карбоксил, фозиноприл включает фосфинильную группу), фармакокинетике, силе ингибирования АПФ в различных органах.
Ингибиторы АПФ, блокируя продукцию ангиотензина II, уменьшают секрецию норадреналина, адреналина, вазопрессина (АДГ) и альдостерона; как ингибиторы кининазы II задерживают инактивацию брадикинина. Они также препятствуют протеолизу предсердного натрийуретического пептида, тормозят образование провоспалительных цитокинов, хемоаттрактантов и молекул клеточной адгезии. Ингибиторы АПФ ослабляют тормозящее действие ангиотензина II на синтетические функции эндотелия.
Таблица 39-2.Ингибиторы ангиотензинпревращающего фермента
| Ингибитор АПФ | Биодоступность, % | Связь с белками плазмы, % | Активный метаболит | Период полуэлиминации, ч | Особенности действия |
| Средства, содержащие сульфгидрильную группу | |||||
| Каптоприл | 25-30 | - | Оказывает выраженное антиоксидантное и эндотелийпротективное действие | ||
| Средства, содержащие карбоксильную группу (карбоксиалкилпептиды) | |||||
| Средства, имеющие почечный клиренс | |||||
| Лизиноприл | 20-25 | 7-13 | Гидрофильное активное вещество, не преобразуется в диацидное производное, меньше других иАПФ вызывает накопление брадикинина. Рекомендован для лечения артериальной гипертензии у тучных больных, так как не депонируется в жировой ткани | ||
| Периндоприл | 75-95 | Периндоприлат | 27-40 | Значительно улучшает мозговое и коронарное кровообращение; повышает синтез простагландинов в слизистой оболочке желудка и оказывает гастропротективное действие | |
| Хинаприл | Хинаприлат | - | |||
| Цилазаприл | 90-95 | 30-60 | Цилазаприлат | 4-12 | - |
| Эналаприл | Эналаприлат | 4-11 | - |
Окончание табл. 39-2
| Ингибитор АПФ | Биодоступность, % | Связь с белками плазмы, % | Активный метаболит | Период полуэлиминации, ч | Особенности действия |
| Средства, имеющие почечный и желчный клиренс | |||||
| Моэксиприл | Моэксиприлат | 29-30 | Препарат выбора при артериальной гипертензии у женщин в период перименопаузы | ||
| Рамиприл | 50-60 | Рамиприлат | 23-48 | Стимулирует синтез тканевого активатора плазминогена (способствует тромболизису) | |
| Спираприл | 90-95 | 50-60 | Спираприлат | 1,6 | - |
| Трандолаприл | Трандолаприлат | 16-24 | Оказывает самое длительное гипотензивное действие (36-48 ч); эффект сохраняется в течение 1-2 нед после отмены | ||
| Средства, содержащие карбоксильную и сульфгидрильную группы | |||||
| Зофеноприл | 75-85 | Зофеноприлат | 5,5 | Содержит две сульфгидрильные группы, селективно ингибирует АПФ сердца и артерий, значительно повышает выделение NO из эндотелия, активный антиоксидант, имеет выраженные противоатеро-склеротические, кардиопротективные и эндотелийпротективные свойства | |
| Средства, содержащие фосфинильную группу | |||||
| Фозиноприл | Фозиноприлат | 12-15 | - |
В результате они повышают продукцию простагландина E2, простациклина, NO, эндотелиального гиперполяризующего фактора.
Таким образом, сосудорасширяющее действие иАПФ обусловлено снижением в организме количества ангиотензина II, вазопрессина, норадреналина, адреналина, альдостерона, накоплением брадикинина, простагландина E2, простациклина и NO.
Ингибиторы АПФ оказывают прямое влияние на функции сердечнососудистой системы и вызывают метаболический, органопротективный, антипролиферативный, противовоспалительный, противосвертывающий эффекты:
• расширяют артерии и вены, снижают АД;
• расширяют коронарные сосуды и сосуды головного мозга;
• вызывают регресс гиперплазии и гипертрофии гладкомышечных клеток артерий, повышают эластичность крупных артерий (ангиопротективное действие);
• улучшают систолическую и диастолическую функции сердца;
• снижают преднагрузку (расширяют вены, уменьшают ОЦК) и постнагрузку на левый желудочек (расширяют артерии);
• нормализуют ЧСС при тахикардии и оказывают антиаритмическое влияние (тормозят выделение катехоламинов, вход Са2+ в кардиомиоциты, устраняют гипокалиемию);
• вызывают регресс гипертрофии, фиброза и ремоделирования миокарда (снижают секрецию норадреналина, адреналина, альдостерона, эндотелина-1, высвобождение ионов кальция, ослабляют пролиферативные эффекты протоонкогенов и инсулина);
• повышают синтез АТФ, креатинфосфата и гликогена в сердце;
• оказывают мочегонное действие и ликвидируют гипокалиемию (улучшают почечный кровоток, изменяют гормональный баланс);
• уменьшают клубочковую гипертензию, гиперфильтрацию, протеинурию, пролиферацию мезангиальных клеток и образование мезангиального матрикса (нефропротективное действие);
• тормозят агрегацию тромбоцитов (блокируют АТ1-рецепторы тромбоцитов, вызывают накопление цАМФ, уменьшают продукцию фактора Виллебранда, повышают выделение простациклина);
• активируют фибринолиз (подавляют продукцию ингибитора тканевого активатора плазминогена-1);
• оказывают антиоксидантное действие (препятствуют активации под влиянием ангиотензина II ксантиноксидазы, НАДН- и НАДФН-оксидазы, катализирующих образование супероксидных анионов, активируют супероксиддисмутазу; иАПФ с сульфгидрильной группой прямо нейтрализуют свободные радикалы кислорода);
• оказывают эндотелийпротективное действие (повышают выделение из эндотелия NO и тормозят его превращение в пероксинитрильный радикал, уменьшают апоптоз эндотелиальных клеток, стимулируют новообразование капилляров и митозы эндотелия, усиливают действие эндотелиального фактора роста);
• препятствуют развитию атеросклероза (повышают включение холестерина в ЛВП, концентрацию аполипопротеинов A-I и A-II в крови, защищают от повреждения эндотелий, тормозят продукцию цитокинов, молекул клеточной адгезии, факторов роста, пролиферацию и миграцию гладких мышц и моноцитов/макрофагов в интиму сосудов, подавляют трансформацию макрофагов в пенистые клетки, увеличивают стабильность атеросклеротических бляшек);
• улучшают гликемический контроль (при коротком курсе приема повышают у больных сахарным диабетом 2-го типа секрецию инсулина, препятствуют апоптозу β-клеток и фиброзу островков поджелудочной железы, восстанавливают чувствительность тканей к инсулину1).
По степени сродства к тканевым изоферментам иАПФ располагаются в следующем порядке: зофеноприл > хинаприл > рамиприл > периндоприл > лизиноприл > эналаприл > фозиноприл > каптоприл. Липофильная молекула зофеноприла быстро поступает из крови в ткани и селективно блокирует АПФ сердца и артерий. Через 4 ч после приема зофеноприла активность АПФ в сердце снижается на 70-90%, через 24 ч остается уменьшенной на 50% (зофеноприл блокирует АПФ сердца в 6-10 раз сильнее каптоприла и вдвое эффективнее эналаприла). Каптоприл, трандолаприл и эналаприл, проникая через ГЭБ, ингибируют АПФ головного мозга.
Ингибиторы АПФ с сульфгидрильной группой - каптоприл и особенно зофеноприл- обладают выраженным антиоксидантным, противоатеросклеротическим, кардиопротективным и эндотелийпротективным эффектами. Эти препараты способствуют открытию в кардиомиоцитах АТФ-зависимых калиевых каналов, что уменьшает перегрузку клеток ионами кальция; уменьшают повреждение миокарда и нарушение его сократительной функции в условиях ишемии-реперфузии; вызывают накопление в миокарде сосудорасширяющих простагландинов; активируют NO-синтазу и препятствуют ее инактивации свободными радикалами. Зофеноприл оказывает самое сильное в группе иАПФ эндотелийпротективное действие, уменьшает окисление ЛНП и эффективно препятствует развитию атеросклероза.
1 Ингибиторы АПФ уменьшают инактивацию брадикинина - вещества с инсулиноподобным действием, повышающего чувствительность рецепторов к инсулину.
Ингибиторы АПФ отличаются по параметрам фармакокинетики. Липофильный каптоприл и гидрофильный лизиноприл (лизиновый аналог эналаприловой кислоты) действуют исходной молекулой. Период полуэлиминации каптоприла составляет около 3 ч, но при длительном применении его концентрация в крови и продолжительность действия увеличиваются. Это обусловлено непрочной связью сульфгидрильной группы каптоприла с эндогенными тиолами - цистеином и глутатионом. По мере элиминации каптоприл выделяется из депо. Лизиноприл не подвергается биотрансформации и не депонируется в жировой ткани. Метаболиты каптоприла и неизмененный лизиноприл выводятся почками.
Липофильные карбоксиалкилпептиды и фозиноприл являются пролекарствами и преобразуются в активные диацидные производные (эналаприлат и др.) после гидролиза в слизистой оболочке кишечника и печени. Зофеноприлат образуется также в сердце и сосудах. При одновременном приеме ингибиторов метаболизма терапевтическая эффективность пролекарств снижается. Метаболиты элиминируются только почками или почками и печенью.
Ингибиторы АПФ по продолжительности действия можно разделить на три группы:
• короткого действия - каптоприл (назначают 3 раза в сутки);
• со средней продолжительностью действия - эналаприл (назначают 2 раза в сутки);
• длительного действия - зофеноприл, лизиноприл, моэксиприл, периндоприл, рамиприл, трандолаприл, хинаприл, фозиноприл (назначают 1 раз в сутки).
Ингибиторы АПФ применяют главным образом при артериальной гипертензии и левожелудочковой ХСН. Препараты улучшают клиническую симптоматику, качество жизни больных, замедляют прогрессирование заболеваний, препятствуют развитию аритмии, инфаркта миокарда, мозгового инсульта, снижают летальность.
Ингибиторы АПФ эффективны у 50-75% больных мягкой и умеренной эссенциальной и реноваскулярной артериальной гипертензией (у пациентов с односторонним стенозом почечной артерии), хотя только у 10-20% пациентов повышена активность проренина и ренина. Гипотензивный эффект выражен у больных разных возрастных групп, включая людей старше 75 лет. Ингибиторы АПФ улучшают прогноз при осложненной артериальной гипертензии у больных, перенесших инфаркт миокарда, мозговой инсульт, страдающих ХСН, сахарным диабетом, заболеванием почек или имеющих высокий риск ИБС.
Соотношение конечного и пикового Ад составляет для трандолаприла 80-100%, за ним следуют зофеноприл (73%), фозиноприл (64%), лизиноприл (50-70%), рамиприл (50-63%), эналаприл (40-64%). Остаточный эффект каптоприла составляет 25%. Таким образом, большинство иАПФ снижают АД в течение суток равномерно, без опасных подъемов в утренние часы.
Лечебное действие иАПФ при длительной терапии может ослабляться (феномен ускользания). Это обусловлено активацией проренина и ренина, преобразованием ангиотензина I в ангиотензин II без участия АПФ, ростом секреции альдостерона. После прекращения лечения синдром отдачи не развивается, так как увеличение содержания ангиотензина II в крови сопровождается подавлением синтеза ангиотензиногена в печени.
При гипертоническом кризе назначают каптоприл под язык, вливают в вену в виде болюса каптоприл или эналаприлат. Особенно эти иАПФ эффективны для купирования криза у больных острой левожелудочковой сердечной недостаточностью.
Ингибиторы АПФ, особенно часто моэксиприл, применяют для лечения артериальной гипертензии и ХСН у женщин в перименопаузе. Повышение АД и дисфункция левого желудочка у таких больных обусловлены дефицитом эстрогенов, что ведет к нарушению продукции простагландина Е2, простациклина, избыточному образованию тромбоксана А2, преобладанию атерогенных фракций липопротеинов. Ингибиторы АПФ снижают АД, препятствуют ремоделированию левого желудочка, ослабляют клинические симптомы климакса, а также, подавляя зависимую от ангиотензина II стимуляцию остеокластов, задерживают развитие остеопороза.
Ингибиторы АПФ оценивают как основные средства лечения ХСН II-IV функционального класса, вызванной систолической и диастолической дисфункцией левого желудочка. При систолическом АД 90100 мм рт.ст. лечение начинают с назначения иАПФ в малых дозах, затем дозы удваивают 1 раз в течение 1-2 нед под контролем АД до достижения целевой дозы.
Ингибиторы АПФ применяют при стабильной стенокардии, протекающей в сочетании с артериальной гипертензией и систолической дисфункцией левого желудочка. Препараты оказывают противоишемическое действие, улучшают функции эндотелия, препятствуют прогрессированию атеросклероза и развитию сердечно-сосудистых осложнений, уменьшают число ишемических событий после аортокоронарного шунтирования.
При инфаркте миокарда иАПФ сокращают размер зоны некроза, расширяют коронарные сосуды, снижают потребность сердца в кислороде, улучшают сердечную деятельность, обладают антиаритмическими и эндотелийпротективными свойствами, препятствуют тромбообразованию, развитию постинфарктного ремоделирования левого желудочка и ХСН. На фоне приема иАПФ реже возникают реперфузионные осложнения тромболитической терапии и повторный инфаркт. Лучших результатов достигают у больных инфарктом миокарда левого желудочка с передней локализацией и симптомами систолической дисфункции, получавших иАПФ в малых дозах через 24-48 ч после коронарной катастрофы. Не рекомендуют применение иАПФ в 1-е сутки после инфаркта, когда из-за нестабильности гемодинамики возникает артериальная гипотензия с ухудшением коронарного кровотока и снабжения миокарда кислородом. Исключение составляет кардиоселективный иАПФ зофеноприл, меньше снижающий АД. Его можно назначать уже в первые часы после инфаркта. При постинфарктной ХСН иАПФ принимают постоянно.
При нетяжелом хроническом гломерулонефрите иАПФ, расширяя выносящую артериолу, уменьшают внутриклубочковую гипертензию, гиперфильтрацию, протеинурию, риск развития нефросклероза, повышают функциональный резерв почечных клубочков.
У больных сахарным диабетом наряду с сахароснижающими средствами применяют иАПФ для профилактики диабетической нефропатии, если диагностируют внутриклубочковую гипертензию. На стадии микроальбуминурии иАПФ вызывают регресс диабетической нефропатии, препятствуя набуханию и деструкции базальной мембраны капилляров, окклюзии капилляров, протеинурии, формированию нефросклероза. На стадии необратимой протеинурии иАПФ задерживают развитие почечной недостаточности. Нефропротективный эффект иАПФ повышается при сочетании с низкосолевой диетой (поваренной соли не более 5 г/сут) и не зависит от наличия или отсутствия артериальной гипертензии. Ингибиторы АПФ также препятствуют гибели островков поджелудочной железы, гликозилированию гемоглобина, ослабляют инсулинорезистентность, замедляют прогрессирование ретинопатии.
Ингибиторы АПФ оказывают лечебное действие при легочном сердце и легочной гипертензии на фоне тяжелых приобретенных и врожденных пороков сердца, а также при болезни Рейно и системной склеродермии .
Выпускают комбинированные препараты капозид♠ (каптоприл+ гидрохлоротиазид), экватор♠ (лизиноприл+амлодипин), коренитек♠ (эналаприл+гидрохлоротиазид), энзикс♠ (эналаприл+индапамид), нолипрел♠(периндоприл+индапамид) и др.
Ингибиторы АПФ отличаются низкой токсичностью. Изредка они вызывают артериальную гипотензию первой дозы с симптомами пониженного кровоснабжения сердца, почек и головного мозга. Артериальная гипотензия особенно выражена при высокой активности ренина в крови. У больных тяжелой ХСН с гиповолемией и гипонатриемией и при хронической почечной недостаточности назначение иАПФ может вызвать срыв компенсаторной перестройки внутрипочечного кровообращения: снижается внутриклубочковое давление, происходит сброс крови через атрофированные клубочки, нарушается фильтрация, возникают протеинурия, рост уровня креатинина в крови и гиперкалиемия. Риск нефротоксичности повышается у пожилых, при одновременном применении с НПВС, сильнодействующими диуретиками и тиазидами. Гиперкалиемию усиливают калийсберегающие диуретики.
У 5-20% пациентов лечение иАПФ сопровождается персистирующим сухим кашлем вследствие накопления брадикинина, субстанции Р, нейропептида Y и нейрокинина А и выделения под их влиянием гистамина и простагландина Е2 в слизистой оболочке бронхов. Эти вещества раздражают рецепторы волокон С чувствительных нервов, образующих афферентное звено кашлевого рефлекса. Сухой кашель, как правило, не требует отмены препаратов. Его трудно отличить от кашля, вызванного застоем крови в легких.
При длительном назначении иАПФ известны редкие случаи анемии, нейтропении, агранулоцитоза, патологии печени, расстройства вкуса, синдрома «обожженного языка». Нарушения кроветворения обусловлены устранением стимулирующего влияния ангиотензина II на эритропоэз и повышением содержания циркулирующего пептида N-ацетил-серил-аспартил-лизил-пролина, тормозящего созревание гемопоэтических стволовых клеток (этот пептид инактивируется при участии АПФ).
Аллергические реакции на иАПФ проявляются зудящей макулопапулезной сыпью (у 1-5% больных) и ангионевротическим отеком (у 0,1-0,2%).
Ингибиторы АПФ оказывают фетотоксическое и тератогенное действие. Они могут вызывать у плода олигогидроамниоз1, тубулярную нефропатию, гипоплазию легких и почек, контрактуру конечностей, недоразвитие затылочной кости с возникновением экзэнцефалии2 , становятся причиной длительной анурии и анемии в раннем постнатальном периоде.
Ингибиторы АПФ противопоказаны при артериальной гипотензии (систолическое АД <90-100 мм рт.ст.), тяжелом аортальном стенозе, двустороннем стенозе почечных артерий или стенозе артерии единственной почки, первичном гиперальдостеронизме, индивидуальной непереносимости (ангионевротическом отеке в анамнезе), беременности, лактации. При аортальном стенозе иАПФ могут ухудшать коронарный кровоток. У пациентов со стенозом почечной артерии лечение иАПФ создает опасность парадоксальной артериальной гипертензии и обратимой острой почечной недостаточности. При хронической почечной недостаточности дозу всех иАПФ уменьшают на 25-50%.
Дата добавления: 2016-02-20; просмотров: 3079;
