Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса
При сравнении уравнения для ТПС с уравнением Аррениуса обнаруживается, что
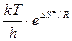 (8.44)
(8.44)
и соответствует А в уравнении Аррениуса, т.е.
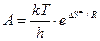 . (8.45)
. (8.45)
Значит определив опытным путем А, можно рассчитать энтропию активации DS¹, которая дает важную информацию о механизме образования активированного комплекса. Например, чем более жестко связывается фермент с субстратом, т.е. образуется большее число связей, тем больше уменьшается DS¹. Величина DН¹ практически равна энергии активации.
Поскольку А=РZ, то:
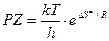 . (8.46)
. (8.46)
Так как Z – теоретическое число столкновений и kT/h практически постоянны, вероятностный фактор Р будет, очевидно, связан с энтропией активации DS¹. Если она велика и положительна, то фактор Р велик, и реакция будет быстрой. Но если DS¹ отрицательна и мала, то реакция будет медленной, т.е. чем больше возрастание энтропии, тем больше вероятность переходного состояния.
Поскольку kT/h соответствует Z и равно при 298К 6,3× 10-12 сек-1, то это число равно числу активных комплексов, разлагающихся за 1 сек. в 1 см3 или количеству соударений в 1 сек. в 1 см3.
Таким образом, скорость реакции, согласно теории переходного состояния, зависит от двух факторов:
1) энергетического фактора – DН¹, энтальпии активации (чем больше энтальпия активации, тем меньше скорость реакции);
2) энтропийного фактора – DS¹, энтропии активации (чем больше энтропия активации, тем больше скорость реакции).
Учет энтропийного фактора для кинетики реакций во многих отношениях оказался плодотворным и впервые позволил установить связь константы скорости со строением молекул реагирующих веществ. При этом теория ПС оперирует, в частности, величинами расстояний между атомами в молекулах, взаимной ориентацией молекул, т.е. параметрами геометрического характера.
Теория активных соударений позволяет при знании энергии активации рассчитать общее число эффективных соударений и отсюда скорость реакции, не объясняя механизма реакции. В отличие от теории активных соударений теория ПК сопоставляет различные возможные комплексы, выявляет большую или меньшую их достижимость и определяет в результате энергетически наиболее выгодный путь реакции.
Для вычисления скоростей взаимодействия двух атомов две теории дают одинаковые результаты. В случае нелинейных многоатомных молекул теория ПК дает значение скоростей, отличных от значений, которые дает теория соударений. Если известна конфигурация реагирующих молекул и активного комплекса, теория ПК позволяет рассчитать предэкспоненциальный множитель. К сожалению, в большинстве случаев строение активированного комплекса и его свойства неизвестны и это затрудняет расчеты.
Таким образом, две теории дополняют друг друга. Теория ПК применяется для вычисления абсолютных скоростей электродных процессов, процессов диффузии и т.д. Теория активных соударений хорошо описывает, как правило, реакции в газовой среде.
Дата добавления: 2016-02-09; просмотров: 1100;
