Вывод основного уравнения теории переходного состояния
В основу теории также положено представление о столкновении молекул как непременном условии реакции. Но она рассматривает то, что происходит в момент столкновения.
Для реакции А + В = С в соответствии с теорией переходного состояния следует: А + В « х* ® С, где х* – переходной комплекс (пк). Что подразумевается под переходным комплексом? После столкновения молекул А и В начинается перераспределение химических связей и образование переходного комплекса. переходный комплекс представляет такое состояние взаимодействующих молекул, когда старые связи еще не полностью разорвались, а новые еще не полностью сформировались. В результате мы имеем состояние промежуточное между А, В и С. Переходное состояние характеризуется непрерывным изменением расстояний между взаимодействующими атомами. В этом существенное отличие переходного комплекса от обычной молекулы, в которой средние расстояния между атомами не зависят от времени. Переходный комплекс также не следует путать с промежуточными веществами. Он является динамической структурой, для образования которой требуется затрата энергии.Энергия, необходимая для перевода реагирующих молекул в состояние переходного комплекса, носит название энергии активации. Так как исходные молекулы еще не распались, то энергия перехода в активированное состояние меньше энергии разрыва связей в молекулах исходных веществ:
Еа < Едиссоциации.
Таким образом, формирование переходного комплекса – процесс энергетически более выгодный, чем полный распад вступающих в реакцию молекул. С другой стороны, превращение активированного комплекса в продукты реакции всегда является экзотермическим процессом.
Основной постулат теории переходного состояния заключается в том, что исходные вещества всегда находятся в равновесии с переходным комплексом:
А + в « х* ® С.
В этом случае kхимического равновесия переходного комплекса равна:
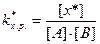 , (8.31)
, (8.31)
а концентрация х составит:
 . (8.32)
. (8.32)
Затем ПК распадается необратимо с образованием продукта С. Характеристикой (количественной) распада будет частота распада ПК – Р. Из статистической механики известно, что Р зависит только от температуры. Эта зависимость имеет вид Р = kТ/h, где k – постоянная Больцмана; h – постоянная Планка; Т – абсолютная температура.
Значит, для данной температуры число Р одинаково для всех переходных состояний, а скорость любой химической реакции определяется лишь концентрацией ПК:
 . (8.33)
. (8.33)
Концентрация ПК связана с концентрацией реагентов и поэтому, подставив их выражения, получим:
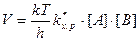 . (8.34)
. (8.34)
К элементарной реакции взаимодействия применим закон действия масс:
V = kV[А][B], (8.35)
символ kV употребляется для константы скорости в отличие от константы Больцмана.
Приравняем правые части уравнений и получим:
 (8.36)
(8.36)
или
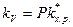 . (8.37)
. (8.37)
Из уравнения видно, что при данной температуре константа скорости реакции зависит от константы химического равновесия образования ПК и от частоты распада ПК. Уравнение называется основным уравнением теории переходного состояния.
Дата добавления: 2016-02-09; просмотров: 981;
