Анализ уравнения (*).
С ростом концентрации компонента А его парциальное давление, согласно условию р 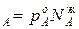 , всегда растет и увеличивается на dp
, всегда растет и увеличивается на dp 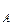 /dN
/dN 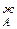 . Одновременно растет общее давление р за счет более летучего компонента А. При dp/dN
. Одновременно растет общее давление р за счет более летучего компонента А. При dp/dN 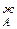 >0 согласно уравнению
>0 согласно уравнению 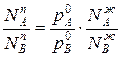 , N
, N 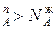 , и подтверждается условие N
, и подтверждается условие N 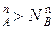 , N
, N 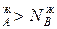 ,а пар обогащается более летучим компонентом, что соответствует первому закону Коновалова.
,а пар обогащается более летучим компонентом, что соответствует первому закону Коновалова.
Для определения экстремума на кривой, описываемой уравнением 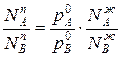 необходимо предположить, что dp
необходимо предположить, что dp 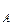 /dN
/dN 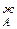 =0. Это означает N
=0. Это означает N 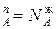 , N
, N 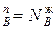 , характерное для азеотропных точек в соответствии со вторым законом Коновалова.
, характерное для азеотропных точек в соответствии со вторым законом Коновалова.
Перегонка (дистилляция) и ректификация.
Правило рычага.
Законы Коновалова являются необходимой теоретической основой процесса разделения летучих компонентов жидких растворов. Состав жидкой и паровой фаз определяется температурой при постоянном давлении или давлением при постоянной температуре.
Соотношение между жидкой и паровой фазами в гетерогенной области II диаграммы состава двухкомпонентной системы находят по правилу рычага.
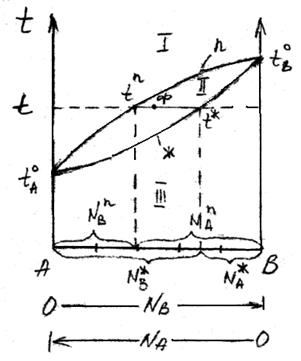
При температуре t состав пара будет определяться фигуративной точкой t 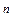 ,а жидкости –t
,а жидкости –t 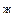 . Состав гетерогенной системы, состоящей в равновесном состоянии из жидкости и пара, определяется точками, расположенными на прямой t
. Состав гетерогенной системы, состоящей в равновесном состоянии из жидкости и пара, определяется точками, расположенными на прямой t 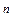 – t
– t 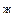 .Когда обе фазы взяты в одинаковых количествах, точка, определяющая состав фаз, находится точно посередине прямой t
.Когда обе фазы взяты в одинаковых количествах, точка, определяющая состав фаз, находится точно посередине прямой t 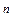 – t
– t 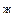 . Если количество жидкой фазы превышает, например, три раза, количество паровой, точка Ф смещается ближе к t
. Если количество жидкой фазы превышает, например, три раза, количество паровой, точка Ф смещается ближе к t 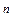 так, что её расстояние до t
так, что её расстояние до t 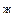 будет в три раза больше, чем до t
будет в три раза больше, чем до t 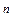 .
.
В общем случае, когда число молей компонентов в паровой и жидкой фазах равно n 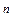 и n
и n 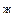 , отношения отрезков t
, отношения отрезков t 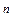 Ф и Ф t
Ф и Ф t 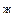 , отсекаемых точкой Ф, обратно пропорционально числу молей паровой и жидкой фаз, т.е.
, отсекаемых точкой Ф, обратно пропорционально числу молей паровой и жидкой фаз, т.е.
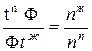
Это равенство и отражает правило рычага, которое гласит: отрезки на прямой, соединяющей на диаграмме состава двухкомпонентной системы паровую и жидкую фазы, отсекаемые определенной точкой на этой прямой, обратно пропорциональны числу молей каждой из фаз.
Дистилляцией, или дробной перегонкой, называют разделение жидких растворов, основанное на отличии состава жидкости от состава образующегося из нее пара. Дистилляция осуществляется путем частичного испарения и последующей конденсации пара. Отогнанная фракция (дистиллят) обогащена более летучим (низкокипящим) компонентом, а неотогнанная жидкость, называемая кубовым остатком (конденсатом)- менее летучим (высококипящим) компонентом.
Рассмотрим дистилляцию системы без экстремумов.
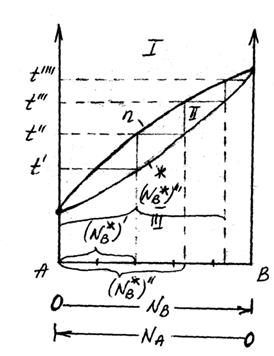
Нагреваем жидкий раствор до температуры t  , в конденсате остается компонент В, мольная доля которого составляет (N
, в конденсате остается компонент В, мольная доля которого составляет (N 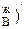 . Если увеличить температуру и нагревать конденсат до температуры t
. Если увеличить температуру и нагревать конденсат до температуры t  , то мольная доля компонента В увеличиться и будет составлять (N
, то мольная доля компонента В увеличиться и будет составлять (N 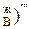 , а при t
, а при t 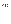 -(N
-(N 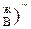 . При дальнейшем увеличении температуры до t
. При дальнейшем увеличении температуры до t 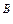 в процессе дистилляции мольная доля высококипящего компонента В в конденсате все время будет увеличиваться, пока не достигнет единицы, т.е. (N
в процессе дистилляции мольная доля высококипящего компонента В в конденсате все время будет увеличиваться, пока не достигнет единицы, т.е. (N 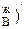 <(N
<(N 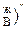 <(N
<(N 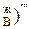 <1.
<1.
Это условие означает, что окончательно кубовый остаток будет состоять из одного высококипящего компонента В, а низкокипящий компонент А полностью перейдет в дистиллят. Таким образом, жидкий раствор удается разделить на два компонента.
Количественно оценку дистилляции проводят при помощи коэффициента разделения, который можно представить в виде:
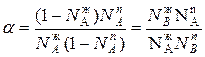
Для простейших систем коэффициент разделения не зависит от состава системы и равен 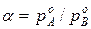 .
.
Коэффициент разделения определяет содержание компонента в паровой фазе относительно его содержанию в жидкой фазе.
Пример. Расчет коэффициента разделения жидкого раствора хлороформа CHCl 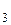 (более летучий, компонент А) и четыреххлористого углерода CCl
(более летучий, компонент А) и четыреххлористого углерода CCl 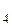 ,близкого к идеальному и содержащего 1 моль CCl
,близкого к идеальному и содержащего 1 моль CCl 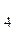 (
( 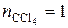 ) и 3 моль CHCl
) и 3 моль CHCl 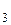 (
( 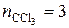 ).Мольная доля компонента CCl
).Мольная доля компонента CCl 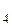 (N
(N 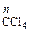 ) в паровой фазе равна 0,193. При 25
) в паровой фазе равна 0,193. При 25 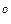 С давление пара р
С давление пара р 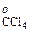 =0,1907
=0,1907 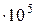 Па, а для хлороформа р
Па, а для хлороформа р 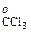 =0,2653
=0,2653 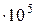 Па.
Па.
Проведем расчет коэффициента разделения для системы , которую можно считать простейшей и идеальной
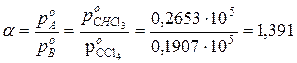 .
.
Мольная доля компонентов системы равны:
N 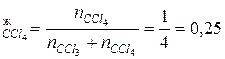 ;
;
N 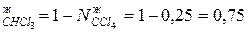 .
.
Мольная доля хлороформа в паровой фазе равна N 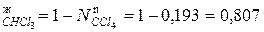 .
.
Коэффициент разделения с учетом состава системы равен
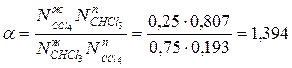 .
.
Компонент А (хлороформ CHCl  ) в паровой фазе в 1,394 раза больше, чем в жидкой. Как видно из приведенного примера, для простейшей системы и раствора, близкого к идеальному, коэффициент разделения, рассчитанный без учета и с учетом состава жидкости, имеет практически одно и то же значение.
) в паровой фазе в 1,394 раза больше, чем в жидкой. Как видно из приведенного примера, для простейшей системы и раствора, близкого к идеальному, коэффициент разделения, рассчитанный без учета и с учетом состава жидкости, имеет практически одно и то же значение.
Таким образом, дистилляция (перегонка) основана на закономерностях изменения давления пара, который находится в равновесии с жидким раствором; при этом давление одного компонента должно быть выше давления другого. Дистилляцию называют простой, если из исходной смеси отгоняется одна фракция, и фракционной (дробной), если отгоняются несколько фракций.
Дата добавления: 2016-02-02; просмотров: 1454;
