Межмолекулярные связи
К основным видам межмолекулярного взаимодействия относят вандерваальсовы силы, водородные связи и донорно-акцепторные взаимодействия.
Вандерваальсовы силыобуславливают притяжение межу молекулами и включают в себя три составлющие: диполь- дипольное взаимодействия, индукционное и дисперсионное взаимодействия.
1. Диполь- дипольное взаимодействие происходит за счет ориентации диполей:

 2. Индукционное взаимодействие. При воздействии диполей на неполярные молекулы возникают наведенные диполи:
2. Индукционное взаимодействие. При воздействии диполей на неполярные молекулы возникают наведенные диполи:





 3. Дисперсионное притяжение возникает за счет возникновения мгновенных диполей и их суммирования:
3. Дисперсионное притяжение возникает за счет возникновения мгновенных диполей и их суммирования:
 |  | ||||||
 | |||||||
 | |||||||
Энергия вандерваальсовых взаимодействий невелика и выражается уравнением: 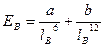 , где a и b - константы, lB - расстояние между молекулами, Ев - энергия.
, где a и b - константы, lB - расстояние между молекулами, Ев - энергия.
Водородная связь- это химическая связь, образованная положительно поляризованным водородом, химически связанным в одной молекуле, и отрицательно поляризованным атомом фтора, кислорода и азота (реже хлора, серы и др.), принадлежащих другой молекуле. Водородная связь может быть внутримолекулярной, если она образуется между двумя группами одной и той же молекулы, и межмолекулярной, если она образуется между разными молекулами (А-Н + В-К = А-Н...В-К).
Энергия и длина водородной связи.Энергия возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов. Водородная связь более прочная, чем вандерваальсово взаимодействие, но менее прочная, чем ковалентная связь. Аналогичную зависимость имеет и длина связи.



 Н 0,036 О Н 0,177 О
Н 0,036 О Н 0,177 О
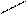 О + Н Н = О......Н Н
О + Н Н = О......Н Н
Н Н
F–H + F- = [ F–H…H ]–
0.092 0.126
Водородные связи очень распространены, так как многие соединения содержат ковалентные полярные связи Н-О и Н-N, например, вода, кристаллогидраты, белки. Многие физические свойства веществ с водородной связью выпадают из общего хода их изменения в ряду атомов. Так, летучесть ассоциированных аномальна мала, а вязкость, диэлектрическая постоянная, теплота парообразования, температура кипения аномально повышенные. В ряду H2O – Н2S - Н2Se – H2Te свойства воды резко отличаются от свойств других веществ. Если бы вода не обладала водородными связями, она имела бы температуру плавления не 0°С, а (-100°С), и температуру кипения не 100°С, а -80°С. Водородная связь влияет и на химические свойства веществ. Так, HF - слабая кислота, тогда как НС1 - сильная. Причина в том, что HF образует с помощью водородной связи дифторид-ионы и другие более сложные ассоциаты.
Дата добавления: 2016-01-30; просмотров: 799;
