Кристаллическое строение вещества 4 страница
1. Раствор сульфата натрия Na2SO4, a(Na+)=1M, a(SO42-)=1M. В растворе имеются ионы Na+, SO42-, Н+, ОН-.
Na2SO4 ↔ 2 Na+ + SO42- ; Н2О ↔ Н+ + ОН-.
Так как φ0(Na+/ Na)=-2,7В<φ0(Н+/ Н2), то на катоде будет восстанавливаться водород, а на аноде – кислород: в растворе 2Н2О ↔ 2Н+ + 2ОН-. На катоде 2Н++2е=Н2. На аноде 2ОН- – 2е = Н2О + 1/2 О2. Суммарной является реакция разложения воды: Н2О=Н2+1/2О2.
2. Раствор хлорида натрия NaCl, a(Na+)=1M, a(Cl-)=1M. В растворе имеются ионы Na+, Cl-, Н+, ОН-. NaСl ↔ Na+ + Cl-; Н2О ↔ Н+ + ОН-.
На катоде пойдет восстановление водорода: 2Н++2е=Н2. На аноде идет окисление ионов хлора: 2Cl- - 2е = Cl2.
Электролиз расплавов
Рассмотрим электролиз расплавов на примере электролиза расплава хлорида натрия. В расплаве хлорида натрия имеются ионы натрия и хлора: NaСl ↔ Na+ + Cl-; если погрузить в расплавленную соль два графитовых электрода и подключить их к полюсам внешнего источника тока, то в электролите начнется направленное движение ионов и на электродах будут протекать следующие реакции:
1) Катодный процесс – восстановление ионов натрия до металлического натрия (на отрицательном электроде) Na+ + е = Na+.
2) Анодный процесс – окисление ионов хлора на положительном электроде (с которого электроны идут во внешнюю цепь) 2Cl- - 2е = Cl2. Суммарная реакция 2NaCl = 2Na + Cl2.
Перенапряжение и поляризация
В процессе электролиза происходит изменение состава электродов с поверхности из-за образования на них продуктов электролиза. При этом образуется гальванический элемент, сила тока которого направлена обратно течению процесса электролиза. Это явление называется химической поляризацией. Для протекания электролиза необходимо приложить к электродам напряжение, большее, чем ЭДС образованного гальванического элемента. Наименьшая разность потенциалов, при которой протекает электролиз, называется потенциалом разложения Еразл.. Разность между потенциалом разложения и ЭДС гальванического элемента называется перенапряжением η.
Перенапряжение – это величина, которая показывает, насколько смещается электродный потенциал от равновесного значения.
Как катодное, так и анодное перенапряжение зависят от материала электродов, состояния их поверхности, от природы разряжающихся ионов и плотности тока.
Перенапряжение при электролизе может достигать значительной величины, что приводит к добавочному расходу электроэнергии. Поэтому стремятся создать такие условия, при которых величина η становится по возможности минимальной. Это достигается путем создания невысокой плотности тока.
Законы Фарадея
Электрохимические процессы на электродах подчиняются законам М. Фарадея.
1 закон Фарадея: массы веществ m, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества q, прошедшему через электролит: m=kq. Масса вещества, выделяющегося при прохождении одного кулона, называется электрохимическим эквивалентом k.
2 закон Фарадея: одинаковые количества электричества выделяют при электролизе на электродах эквивалентные массы веществ. Для выделения на электроде одного грамм-эквивалента любого вещества необходимо затратить одно и то же количества электричества, а именно 96500 Кл (называемого числом Фарадея).
Масса металла при электролизе на катоде, согласно законам Фарадея, может быть вычислена по формуле:
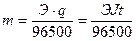 .
.
Здесь m – масса металла, г; Э – химический эквивалент металла, г/моль; t – продолжительность электролиза, с.
При электролизе во многих случаях выделяется веществ меньше, чем должно получиться по законам Фарадея. Это объясняется тем, что наряду с основными электродными процессами окисления и восстановления протекают побочные, параллельные процессы (в результате химической поляризации). Поэтому вводится понятие выхода по току χ, %. Оно представляет собой отношение массы полученного вещества в данных условиях электролиза mпр к массе, теоретически вычисленной на основании закона Фарадея mтеор:
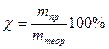
Применение электролиза
Электролиз широко используется в различных областях промышленности. Практически нет ни одной области техники, где бы он не применялся.
Электролиз в металлургии. Электролизом растворов солей получают медь, цинк, кадмий, никель, кобальт, марганец и другие металлы. На катоде происходит разряд ионов металла из раствора Mn+ + ne = M. В этих процессах используют нерастворимые аноды, на которых выделяется кислород: 2Н2О + 4е = О2 + 4Н+.
Метод электролиза используют для рафинирования металлов – меди, серебра, золота, свинца, олова и других. Анодом при рафинировании служит очищаемый металл. На аноде происходит растворение основного металла и примесей, потенциал которых отрицательнее потенциала основного металла. На катоде выделяется металл, имеющий более положительный потенциал. Так как потенциалы меди, серебра, свинца и олова положительнее, чем потенциалы других основных металлов ,то каждый из этих металлов в первую очередь выделяется на катоде, а примеси остаются в растворе.
Электролиз в химической промышленности. К наиболее крупномасштабному электролитическому процессу в химической промышленности относится электролиз раствора хлорида натрия с получением газообразных водорода и хлора на электродах и щелочи в электролизере. Кроме этого, электролизом получают фтор из расплава смеси плавиковой кислоты и фторида натрия, водород и кислород из воды, диоксид марганца из раствора сульфата марганца.
Получение гальванопокрытий. Гальваническими называются металлические покрытия, наносимые на поверхность какого-либо изделия методом электролиза. Гальваническим способом можно получить покрытия для всех металлов и сплавов. Наиболее распространены никелирование, хромирование, меднение и цинкование.
Нанесение гальванических покрытий проводится в электролизере, называемом гальванической ванной. Катодом служит изделие, на которое наносится покрытие. На катоде идёт процесс восстановления находящихся в растворе электролита ионов металла Mn+ + ne = M. Анодом обычно служит тот же металл, что и металл-покрытие. Процесс на аноде противоположен процессу на катоде: M – ne = Mn+
Электрохимическая анодная обработка металлов и сплавов. Анодная обработка изделий для придания им требуемой формы получила название электрохимической обработки металлов (ЭХОМ). Этот способ обработки металлов имеет важные достоинства, так как позволяет обрабатывать детали сложной конфигурации. Как и при обычном электролизе с растворимыми анодами, при ЭХОМ происходит анодное растворение металла M – ne = Mn+. На катоде, который называют инструментом, обычно выделяется водород 2Н++2е=Н2. Особенностью ЭХОМ по сравнению с другими методами электролиза является высокая скорость растворения металлов. В настоящее время ЭХОМ используется для обработки лопаток турбин, штампов и пресс-форм, твёрдых и тугоплавких металлов.
ЛЕКЦИЯ ПО ТЕМЕ: «Коррозия металлов»
План
1. Определение коррозии и причины её возникновения
2. Классификация коррозионных процессов. Химическая и электрохимическая коррозия
3. Коррозия металлов в различных средах
3.1. Контактная коррозия
3.2. Атмосферная коррозия
3.3. Подземная коррозия
3.4. Коррозия под действием блуждающих токов
4. Виды коррозионных разрушений
Определение коррозии и причины её возникновения
Коррозия – это самопроизвольный процесс разрушения металлов и сплавов в условиях природной среды.
При коррозии металлы окисляются и образуются продукты, состав которых зависит от условий среды.
Согласно современным представлениям, все основные изменения в органическом и неорганическом мире связаны с окислительно-восстановительными процессами. Окислительно-восстановительные реакции лежат в основе и коррозионных процессов.
Основной причиной коррозии является термодинамическая неустойчивость металлов и сплавов в окружающей среде. Подавляющее большинство металлов в земной коре находится в виде оксидов, сульфидов и других соединений. При получении металлов в металлургии их переводят из такого стабильного состояния в элементарную форму, которая нестабильна. При контакте металла с внешней окислительной средой появляется движущая сила, стремящаяся превратить их в стабильные соединения, подобные тем, которые находятся в рудах. Примером этого является коррозия стали. В результате этого элементарное железо превращается в окисленное двух- и трёхвалентное, которое соответствует таким минералам, как магнетит (Fe3O4) или лимонит (Fe2O3˙H2O).
Термодинамическая неустойчивость металлов количественно оценивается знаком и величиной изобарно-изотермического потенциала ΔG (энергии Гиббса). Самопроизвольно протекают те процессы, которые сопровождаются уменьшением энергии Гиббса, то есть для которых ΔG<0. Металлы, стоящие в ряду напряжений до водорода, имеют по сравнению с водородом более отрицательный потенциал, их окисленное состояние термодинамически более устойчиво, чем восстановленное. Для металлов, расположенных после водорода, восстановленное состояние термодинамически более устойчиво, то есть для них ΔG>0. К этой группе металлов относятся коррозионно-стойкие золото, платина, серебро и др.
Классификация коррозионных процессов. Химическая и электрохимическая коррозия
Коррозионные процессы классифицируются:
1. По механизму реакций взаимодействия металла со средой;
2. По типу коррозионной среды;
3. По характеру коррозионных разрушений на поверхности и в объёме металла;
4. По характеру механических воздействий, которым подвергается металл одновременно с действием коррозионной среды.
По первому признаку различают два вида коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия протекает при взаимодействии металлов с окислителями в средах, не проводящих электрический ток. Механизм химической коррозии можно представить одностадийным процессом окисления металла, то есть взаимодействием поверхности металла с окислителем.
Химическая коррозия – это процесс самопроизвольного разрушения металла в среде окислительного газа (например, кислорода) при повышенной температуре. Скорость химической коррозии зависит от многих факторов, в первую очередь она определяется характером продуктов коррозии. При окислении на поверхности металла образуется твердая пленка оксидов. Скорость окисления определяется состоянием и защитными свойствами поверхностной плёнки. Это зависит от отношения объёмов оксидной плёнки Vок и прокорродированного металла Vм, из которого она образовалась. Установлено, что для пористых плёнок, не предохраняющих металл от доступа агрессивных примесей воздуха 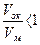 . А для плёнок, обладающими защитными свойствами,
. А для плёнок, обладающими защитными свойствами, 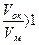 .
.
Скорость химической коррозии возрастает с увеличением температуры из-за повышения коэффициента диффузии и изменения защитных свойств плёнки. Резкие изменения температуры часто вызывают быстрое разрушение защитной плёнки. Это связано с различными коэффициентами термического расширения металла и плёнки.
По условиям протекания коррозионного процесса различают газовую коррозию (протекающую в газах, парах при высокой температуре в отсутствие воды), и коррозию в жидкостях – неэлектролитах (нефть, фенол, бензин, бензол).
Электрохимическая коррозия
При электрохимической коррозии процесс взаимодействия металла с окислителем состоит из двух сопряженных реакций: анодного растворения металла и катодного восстановления окислителя. Эта коррозия может протекать в электролитах, атмосфере любого влажного газа, а также в почве.
Основным отличием электрохимической коррозии от химической является наличие влаги на поверхности металла, что приводит к контакту двух различных металлов через электролит. При этом возникают короткозамкнутые гальванопары, в результате чего появляется электрический ток. В этом случае процесс коррозии обусловлен работой гальванопары, то есть электрохимической реакцией. По этой причине электрохимическая коррозия более агрессивна по отношению к металлам, чем химическая.
Механизм электрохимической коррозии состоит в том, что происходит анодное окисление металла: M – ne = Mn+ и катодное восстановление окислителя (Ох) Ох+ne=Red.
Окислителями при коррозии служат молекулы кислорода, хлора, ионы Н+, Fe3+, NO3– и др. Наиболее часто при коррозии наблюдается ионизация (восстановление) кислорода в нейтральной (щелочной) среде О2+2Н2О+4е=4ОН–, в кислой среде – восстановление водорода 2Н++2е=Н2.
Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с выделением водорода или коррозией с водородной деполяризацией.
Кроме первичных реакций, в растворе протекают вторичные реакции:
Мх++хОН-=М(ОН)х
В результате взаимодействия металла с кислородом, как и при химической коррозии, образуется оксид металла: М(ОН)2=МО+Н2О.
Кроме анодных и катодных реакций при электрохимической коррозии происходит движение электронов в металле и ионов в электролите. Электролитами могут быть растворы солей, кислот и оснований, морская и атмосферная вода (содержащая кислород, углекислый, сернистый и др. газы). Основным отличием электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи.
Равновесные потенциалы водородного и кислородного электродов в зависимости от рН среды находят на основании уравнения Нернста:
φ2Н+/Н2=-0,059рН;
φО2/ОН=1,23-0,059рН.
Коррозия металлов в различных средах
Контактная коррозия
Контактная биметаллическая коррозия является разновидностью электрохимической коррозии, вызванной контактом металлов, имеющих разные электродные потенциалы в электролите. При этом коррозия металла с более отрицательным потенциалом обычно усиливается, а разрушение металла с положительным потенциалом замедляется или полностью прекращается. При конструировании учитывают возможность контактов различных металлов.
Атмосферная коррозия
На скорость атмосферной коррозии влияет влажность и газовый состав атмосферы. Влажность ,температура и степень загрязнения атмосферы влияют на качество и состав образующихся на поверхности металла плёнок. Наиболее агрессивны среды, сильно загрязненные промышленными газами (СО2, SO2, NO2, NH3, HCl), частицами солей и угольной пылью. В промышленных районах атмосферную коррозию могут интенсифицировать так называемые «кислотные дожди», основными агрессивными компонентами которых являются серные и азотные кислоты. Кислотные дожди (рН<4) легко вызывают коррозию сплавов алюминия, железа и цинка.
В зависимости от влажности атмосферы различают несколько видов атмосферной коррозии: мокрую, влажную и сухую. Мокрая атмосферная коррозия при относительной влажности до 100% наблюдается при наличии адсорбционной капиллярной или химической плёнки влаги на поверхности металла. Её толщина составляет от 0,1 мм до 1 мм. Понижение температуры интенсифицирует процесс конденсации и приводит к появлению капель влаги на поверхности металла.
Влажная коррозия возникает при влажности в атмосфере ниже 100%. Толщина плёнки влаги от 100 А0 до 0,1 мм. При влажности воздуха менее 60% наблюдается сухая атмосферная коррозия (коррозия под действием кислорода воздуха). Процесс разрушения металла подчиняется законам, характерным для газовой коррозии.
Подземная коррозия
Коррозионные разрушения металлических конструкций в почвах и грунтах вызываются подземной коррозией. Ей подвержены трубопроводы (водные, газовые, нефтяные), опоры электроконтактной сети и др. Скорость коррозии зависит от пористости и состава почвы, величины рН, наличия микроорганизмов. Подземная коррозия протекает по механизму электрохимической коррозии. Почвенная влага играет роль электролита и процесс коррозии протекает следующими образом:
Анодная реакция Fe-2e=Fe2+
Катодная реакция О2+2Н2О+4е=4ОН–
Реакции в почве Fe2++2OH-=Fe(OH)2, 4Fe(OH)2+2H2O+O2=4Fe(OH)3, 2Fe(OH)3+(n-3)H2O=Fe2O3nH2O.
Поверхность металла в местах ограниченного доступа кислорода выполняет роль катода.
Грунтовая коррозия металлических конструкций чаще всего происходит в условиях, характерных для нейтральных сред, с участием кислорода в качестве деполяризатора. В кислых почвах может происходить коррозия с водородной деполяризацией.
Исследование коррозионной активности грунтов позволили сделать вывод о том, что наиболее коррозионно-активными являются болотистые почвы, торфяники, ил. Песок и известняк практически не коррозионно-активны. Существенное влияние на скорость коррозии металлов оказывает рН почвы. В почвах с рН меньше 6,5 коррозионная активность по отношению к стали повышается. Наибольшей коррозионной активностью обладают почвы с рН<5,5. Нейтральные почвы с рН=6,5–7,5 и слабощелочные до рН=8,5 не коррозионно-активны.
На скорость коррозии влияет также величина удельного электрического сопротивления грунта. Коррозия металлических подземных конструкций зависит от содержания в почве и грунте различных солей. Так, с увеличением содержания хлоридов, сульфатов скорость коррозии возрастает. Повышение температуры также способствует повышению скорости грунтовой коррозии металлов.
Коррозия под действием блуждающих токов
Блуждающими токами называются электрические токи, протекающие в земле при использовании её в качестве токопроводящей среды. Попадая в металлические конструкции, расположенные в грунте, они вызывают коррозию. Источниками возникновения блуждающих токов в почве являются электрифицированные железные дороги постоянного тока, трамваи, линии электропередач.
Поскольку рельсы не достаточно изолированы от земли, а почва является проводником, то часть тока уходит в землю, встречая на своём пути подземные металлические сооружения. Так как контактный провод подсоединен к положительному полюсу тяговой подстанции, а рельс – к отрицательному, то в месте выхода тока из рельса образуется анодная зона, где коррозия разрушает подошву рельса и крепежные детали. При этом, чем меньше переходное сопротивление рельс-земля, тем большая часть тока возвращается к тяговой подстанции через землю и тем интенсивнее анодная зона на рельсе. Этот вид коррозии очень опасен, так как блуждающие токи нередко распространяются на несколько десятков километров и вызывают сильные повреждения металлических конструкций.
Виды коррозионных разрушений
По виду коррозионного разрушения коррозия делится на следующие виды.
1. Сплошная, или общая коррозия. Она может быть равномерной, если фронт коррозионного разрушения распределяется параллельно плоскости металла, и неравномерной, когда скорость коррозии на различных участках неодинакова.
2. Избирательная коррозия. Она характерна для сплавов и твердых растворов.
3. Локальная коррозия. Она связана с образованием и локализацией пораженных коррозией мест в виде «раковин» разной величины.
4. Питтинг - коррозия. Разрушение металла начинается в глубине, с образованием пор; часто приводит к образованию сквозных отверстий.
5. Межкристаллитная коррозия. Разрушение идет по границам металлических кристаллов.
6. Внутрикристаллическая коррозия. Наблюдается при коррозионном растрескивании под действием внешних механических нагрузок или внутренних напряжений.
ЛЕКЦИЯ ПО ТЕМЕ: «Защита металлов от коррозии»
План
1. Легирование металлов
2. Защитные покрытия
3. Электрохимическая защита (катодная, анодная, протекторная). Защита от коррозии блуждающими токами
4. Ингибиторы коррозии
Все методы защиты металлов от коррозии условно делятся на следующие группы: легирование металлов, защитные покрытия, электрохимическая защита, изменение свойств коррозионной среды, рациональное конструирование изделий.
Легирование металлов
Это эффективный метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компонентов применяют хром, никель, вольфрам и другие металлы. Широкое применение нашло легирование для защиты от газовой коррозии. Введение некоторых добавок в стали (титана, меди, хрома и никеля) приводит к тому, что при коррозии образуется плотная плёнка продуктов реакции, предохраняющая сплав от дальнейшей коррозии. При этом обеспечивается жаростойкость и жаропрочность сплавов.
Жаростойкость обычно обеспечивается легированием металлов и сплавов (например, стали хромом, алюминием и кремнием). Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют плотные защитные плёнки оксидов, например, SiO2, Al2O3, Cr2O3. Хром и кремний также улучшают жаропрочность сталей. Легирование также используется с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода. К коррозионностойким сплавам относятся нержавеющие стали, в которых легирующими компонентами служат хром, никель и другие металлы.
Защитные покрытия
Слои, искусственно создаваемые на поверхности металлических изделий для предохранения их от коррозии, называются защитными покрытиями. Применяемые в технике покрытия подразделяются на металлические и неметаллические.
Металлические покрытия. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, олово, хром, серебро), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их можно разделить на анодные и катодные.
К катодным покрытиям относятся покрытия, потенциал которых в данной среде имеют большее значение, чем потенциал основного (покрываемого) металла. В качестве примеров катодных покрытий для стали можно привести медь, никель, кадмий, олово, серебро. При повреждении покрытия возникает коррозионный элемент, в котором основной материал (сталь) служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия.
Анодные покрытия имеют меньший потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стали. В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует.
Для получения металлических защитных покрытий применяются различные способы: электрохимический (гальванические покрытия), погружение в расплавленный металл, термодиффузионный и химический.
Неметаллические защитные покрытия. Они могут быть как неорганическими, так и органическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, полимерными плёнками, резиной.
Электрохимическая защита
Электрохимическую защиту используют для предотвращения разрушения подземных трубопроводов, кабелей, корпусов судов, резервуаров, подводных лодок и т.д.
Электрохимическая защита основана на замедлении катодных и анодных реакций микрогальванических элементов. Она осуществляется присоединением к конструкции источника постоянного тока или дополнительного электрода.
Электрохимическую защиту подразделяют на катодную и анодную.
Катодная защита – наиболее распространенный вид электрохимической защиты. Её используют для борьбы с коррозией таких металлов и сплавов, как сталь, медь, латунь, алюминий в условиях не очень агрессивных сред. Она эффективна для предотвращения коррозионного растрескивания, обесцинкования латуней, питтинга сталей в почвах и морской воде. Наибольшее применение катодная защита получила для борьбы с коррозией подземных сооружений – трубопроводов, газопроводов, кабельных установок.
Катодную поляризацию можно осуществить путём присоединения защищаемой конструкции к отрицательному полюсу (катоду) внешнего источника тока или к металлу, имеющему меньший электродный потенциал. Положительный полюс подсоединяется к вспомогательному электроду, аноду. В процессе защиты анод активно разрушается и подлежит периодическому обновлению. В качестве материла анода применяют лом чугуна, стали, графита и т.п.
Защитный эффект можно оценить по формулам:
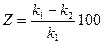 ,
, 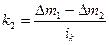 .
.
Здесь z – защитный эффект, к1 – показатель скорости коррозии металла без катодной защиты, к2 – при катодной защите, Δm1 – уменьшение массы металла без катодной защиты, Δm2 – при катодной защите, ik – катодная плотность тока.
Протекторная защита. К защищаемой конструкции присоединяют более электроотрицательный металл – протектор, который, растворяясь в окружающей среде, посылает электроны и катодно поляризует конструкцию. После полного растворения протектора или потери контакта его с защищаемой конструкцией протектор необходимо возобновлять. В качестве протектора чаще всего используют сплавы магния и цинка. Алюминий применяется реже, так как он быстро покрывается очень плотной оксидной плёнкой, которая пассивирует его и ограничивает токоотдачу. Протектор работает эффективно, если его переходное сопротивление (между ним и окружающей средой) невелико. В процессе работы протектор может покрываться слоем продуктов коррозии, которые изолируют его от окружающей среды и резко увеличивают переходное сопротивление. Для борьбы с этим протектор помещают в наполнитель (смесь солей), облегчающую растворение продуктов коррозии. Действие протектора ограничивается определенным расстоянием (радиусом действия). В настоящее время протекторную защиту применяют для борьбы с коррозией металлических конструкций в морской и речной воде, грунте и других нейтральных средах. Использование протекторной защиты в кислых средах ограничивается высокой скоростью саморастворения протектора.
Анодная защита. Скорость электрохимической коррозии металла может быть уменьшена и при его анодной поляризации, если она смещает потенциал защищаемого металла в пассивную область.
Метод анодной защиты имеет относительно ограниченное применение, так как пассивация эффективна в основном в окислительных средах при отсутствии активных ионов (например, ионов хлора для железа). Кроме того, анодная защита потенциально опасна: в случае прерывания подачи тока возможно активирование металла и его интенсивное анодное растворение. поэтому анодная защита требует тщательной системы контроля. Защитная плотность тока достаточно низкое и потребление электроэнергии невелико. Другое достоинство анодной защиты – высокая рассеивающая способность, то есть возможность защиты на более удаленном от катода расстоянии и в электрически экранированных участках.
Метод анодной защиты используют для металлов и сплавов, легко пассивирующихся при анодной поляризации; в химической промышленности – для снижения скорости коррозии низкоуглеродистой стали в серной кислоте и в растворах, содержащих аммиак и нитрат аммония.
Дата добавления: 2016-01-30; просмотров: 591;
