Метод определения общей жесткости воды с помощью трилона Б
Принцип определения. По количеству трилона Б – натриевой соли этилендиаминотетрауксусной кислоты (порошок белого цвета), пошедшего на титрование пробы воды с индикатором эриохромом черным Т, рассчитывают содержание растворенных в ней солей кальция и магния. Так как индикатор меняет свою окраску не только от изменения концентрации ионов кальция и магния, но и в зависимости от рН раствора, в титруемый раствор добавляют буферную смесь (NH4OH + NH4Cl), поддерживающую рН около 10.
Реактивы:
Раствор трилона Б, 0,05 н. раствор: растворяют 9,3 г трилона Б в дистиллированной воде с последующим доведением объема до 1 л.
Буферный раствор: 20 г химически чистой NH4Cl растворяют в дистиллированной воде, добавляют 100 мл 20 %‑ного раствора NH4OH и доводят объем дистиллированной водой до 1 л.
Раствор индикатора: 0,5 г эриохрома черного Т растворяют в 10 мл буферного раствора и доводят объем 96 %‑ным этиловым спиртом до 100 мл.
Ход анализа. В коническую колбу емкостью 200–250 мл наливают 50 мл исследуемой воды, добавляют 5 мл буферной смеси и 10–15 капель индикатора эриохрома черного Т (до появления интенсивного вишнево‑красного цвета). При непрерывном покачивании колбы пробу титруют раствором трилона Б. По мере прибавления трилона Б вишнево‑красный цвет переходит в лиловый. С этого момента титрование следует проводить медленнее. Окончание титрования устанавливают по появлению синего цвета с зеленоватым оттенком.
Расчет. Содержание растворимых в воде солей кальция и магния вычисляют но формуле:
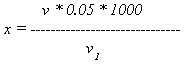
где х – количество растворимых в воде солей кальция и магния, мг‑экв/л;
v – количество трилона Б, пошедшее на титрование, мл;
0,05 – нормальность трилона;
1000 – пересчет на 1 л воды;
v1 – объем исследуемой воды, мл.
Для перевода в градусы жесткости полученную цифру умножают на 2,8.
Определение общей жесткости лучше проводить по таблице 2, составленной В.П. Дацкевичем. В таблице нужно найти цифру, равную количеству трилона Б, пошедшему на титрование. В левой (вертикальной) графе указаны градусы жесткости, в верхней (горизонтальной) – десятые доли градуса. Таблица составлена для анализа, проведенного в 100 мл воды 0,1 н. раствором трилона Б или 0,05 н. раствором, но при исследовании 50 мл воды.
Чтобы приготовить воду нужной жесткости для общего, а в особенности для нерестового аквариумов, сначала следует определить жесткость водопроводной и дистиллированной воды, из которых будет составляться вода для аквариума. Химически обессоленная вода имеет нулевую жесткость. Пользуясь данными таблицы 3, водопроводную воду смешивают с химически обессоленной и получают воду нужной жесткости. Предварительно водопроводную воду подогревают до 90° в течение 30 минут и охлаждают.
Пример. Для аквариума, где будут нереститься неоновые рыбы, требуется вода жесткостью 3°, а мы располагаем водопроводной водой, жесткость которой 8°. В левой вертикальной графе указана требуемая жесткость воды, в горизонтальной графе – жесткость водопроводной воды. В‑горизонтальной графе под цифрой 8 находим цифру, соответствующую 3° жесткости вертикальной графы, – 1666. Значит, для получения воды жесткостью 3° к 1 л водопроводной воды нужно добавить 1666 мл дистиллированной. Далее делаем пересчет на все количество воды нерестового аквариума.
Содержание водородных ионов в воде (рН)
Небольшая часть молекул воды диссоциирована на водородные (Н) и гидроксильные ионы (ОН). В химически чистой воде молярные концентрации этих ионов равны и при 25° составляют 10~7 моль/л. Таким образом, величина произведения обеих концентраций равна 10~14. Эта величина остается постоянной и в присутствии веществ, при диссоциации которых образуются водородные и гидроксильные ионы. Поэтому вполне достаточно установить концентрацию одного из них. Практически определяют концентрацию водородных ионов.
Поскольку концентрация водородных ионов может иметь самое различное значение и подразделяться на несколько порядков, принято выражать ее величиной рН, представляющей собой десятичный логарифм концентрации ионов водорода, взятый с обратным знаком:
(Н+) = 10‑рН, pH = – lg(H+).
Определение концентрации водородных ионов осуществляется в интервале от 1 до 10~14 мг‑экв/л, что соответствует величине рН от 0 до 14; рН 7 отвечает нейтральному состоянию раствора. меньшие ее значения – кислотному, а более высокие – щелочному.
На концентрацию водородных ионов большое влияние оказывает жесткость и количество растворимого углекислого газа, а эти показатели в аквариумной воде постоянно меняются, даже в течение одних суток.
Аквариумист должен уметь определить концентрацию водородных ионов в воде, поскольку она оказывает огромное влияние на рост и развитие рыб и растений. Особое значение приобретает рН воды в периоды размножения рыб и развития икры и личинок (в первые три дня их жизни).
В аквариумной практике в зависимости от величины рН различают воду: рН от 1,0 до 3,0 – сильнокислая, рН от 3 до 5,0 – кислая, рН от 5,0 до 6,0 – слабокислая, рН от 6,0 до 7,0 – очень слабокислая, рН 7,0 – нейтральная, рН от 7,0 до 8,0 – очень слабощелочная, рН от 8,0 до 9,0 – слабощелочная, рН от 9,0 до 10,0 – щелочная и рН выше 10,0 – сильнощелочная. Для нормальной жизни и размножения большинства аквариумных рыб наиболее подходящей является вода, рН которой колеблется от 6 до 8, а для большинства растений оптимальным является рН от 6 до 6,5.
Дата добавления: 2016-01-26; просмотров: 4592;
