Соотношения линейности Бренстеда-Поляни в катализе
Перспективный подход к предвидению каталитического действия твердых катализаторов основан на использовании соотношения линейности Бренстеда-Поляни, суть и основное значение которого состоит в том, что оно устанавливает связь между кинетическими (Е, k, w) и термодинамическими (DH , K ) величинами, характерными для данного каталитического процесса.
Разные формы этого соотношения имеют вид:
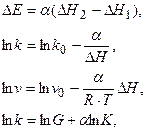 (5.12)
(5.12)
где a, lnk0, lnv0 – постоянные эмпирические коэффициенты в ряду сходных катализаторов для данной реакции и в ряду однотипных реакций для данного катализатора; k, v – константа скорости и скорость реакции, К –константа равновесия, G – энергия Гиббса.
Тепловой эффект реакции (DH) и энергия Гиббса (G) отражают величину энергии разрыва связи катализатор-субстрат.
Рассмотрим для примера реакцию окисления на оксидах металлов в качестве катализатора. Соотношение Бренстеда-Поляни используется в форме:
Е = Е0 + a 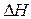 , (5.13)
, (5.13)
где Е0 и a – постоянные, одинаковые в ряду разных оксидов для заданной реакции окисления. Энергия активации реакции для разных катализаторов (Е) и теплота адсорбции кислорода на катализаторе ( 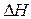 ) (равная энергии связи кислорода (Q) с металлом).
) (равная энергии связи кислорода (Q) с металлом).
Строится график в координатах Е – 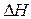 , определяется a и Е0, зная которые можно рассчитать Е по известному
, определяется a и Е0, зная которые можно рассчитать Е по известному 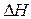 или наоборот для катализаторов, с которыми не проводились опыты. По этим величинам можно судить об активности катализаторов. Корреляция между каталитической активностью и энергией связи кислорода справедлива не только для простых оксидов, но и для более сложных соединений типа шпинелей, солей ванадатов, молибдатов, смешанных оксидов и т.д.
или наоборот для катализаторов, с которыми не проводились опыты. По этим величинам можно судить об активности катализаторов. Корреляция между каталитической активностью и энергией связи кислорода справедлива не только для простых оксидов, но и для более сложных соединений типа шпинелей, солей ванадатов, молибдатов, смешанных оксидов и т.д.
Вопросы для самоконтроля
1. Что является мерой каталитической активности в гомогенном и ферментативном катализе? Каков порядок этой величины в каждом из типов катализа?
2. Какие величины используют для оценки эффективности катализатора в гетерогенном катализе?
3. В чем различие терминов «интегральная» и «дифференциальная» селективность? Ответ поясните.
4. Во сколько раз увеличиться скорость химической реакции при изменении активационного барьера на: а) 4 кДж/моль;б) 40 кДж/моль.
Дата добавления: 2016-01-09; просмотров: 1797;
