Механизмы гомогенных каталитических реакций
Промежуточное химическое взаимодействие реагентов с катализатором может протекать по двум видам механизма – слитно и раздельно.
При слитном механизме с состав активированного комплекса (промежуточного соединения) входят, наряду с катализатором, все реагирующие вещества и реакция идёт по схеме:
1. A + B ® AB 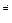 ® D + E без катализатора,
® D + E без катализатора,
2. A + B +K® ABK 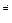 ® D + E + K c катализатором.
® D + E + K c катализатором.
Увеличение скорости реакции в этом случае объясняется уменьшением энергии активации процесса
При раздельном механизме каталитический процесс осуществляется поэтапно:
3. 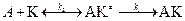 .
.
4. 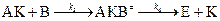 .
.
Все соединения со значком ( 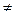 ) означают активированный комплекс системы, находящейся в переходном состоянии. В этих реакциях суммарная энергия активации реакции необязательно должна уменьшаться, а скорость процесса растёт за счёт роста энтропийного фактора, так как при этом растёт количество стадий и упрощается строение активированных комплексов. Реакции с раздельным и слитным механизмом протекают при разных температурах; первые – при 600 – 800 К, а вторые – в области 300 - 400 К.
) означают активированный комплекс системы, находящейся в переходном состоянии. В этих реакциях суммарная энергия активации реакции необязательно должна уменьшаться, а скорость процесса растёт за счёт роста энтропийного фактора, так как при этом растёт количество стадий и упрощается строение активированных комплексов. Реакции с раздельным и слитным механизмом протекают при разных температурах; первые – при 600 – 800 К, а вторые – в области 300 - 400 К.
Как правило, катализатор снижает энергию активации реакции и ускоряет её. Замедлить реакцию (не цепную) катализатор не может, так как если в присутствии катализатора энергия активации растёт, то реакция пойдёт по обычному, не каталитическому пути и скорость её окажется прежней. Замедляющее действие катализатор может оказывать на цепную реакцию, когда он ускоряет стадию обрыва цепи.
Рассмотрим реакцию, протекающую по раздельному механизму [см. уравнения (3), (4)]. Согласно теории активированного комплекса, скорость реакции определяется скоростью распада комплекса на конечные продукты:
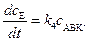 . (5.14)
. (5.14)
В соответствии с принципом стационарности:
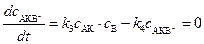 . (5.15)
. (5.15)
Откуда:
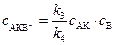 , (6.16)
, (6.16)
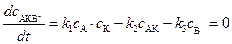 , (5.17)
, (5.17)

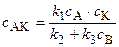 . (5.18)
. (5.18)
Подставляя (5.18) в (5.16) и затем в (5.14), находим:
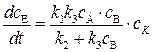 . (5.19)
. (5.19)
Это уравнение лежит в основе кинетики гетерогенно–каталитических реакций.
Из (5.19) видно, что скорость образования продукта реакции прямо пропорциональна концентрации катализатора сК, что хорошо согласуется с опытом.
Характерные частные случаи:
1) если k2>>k3, т.е. константа скорости распада промежуточного соединения АК на исходные реагенты значительно превышает константу скорости образования активированного комплекса AKB 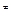 , то
, то
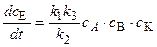 , (5.20)
, (5.20)
т.е. скорость реакции прямо пропорциональна концентрации катализатора и реагентов. Промежуточное вещество (АК) называется промежуточным веществом Аррениуса.
2) если k2 << k3 , тогда всё количество промежуточного вещества превращается в конечные продукты и скорость реакции пропорциональна концентрации вещества (A), из которого образуется вещество (АК):
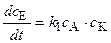 . (5.21)
. (5.21)
Промежуточное вещество в этом случае носит название ²промежуточное вещество Вант Гоффа². Например, реакция окисления тиосульфата перекисью водорода в кислой среде с I– ионами
2S2O32- + H2O2 + 2H+ ® S4O62- + 2H2O
идёт по стадиям:
I– + H2O2 ® IO- + H2O,
I-+ IO– + 2H+ ® I2 + H2O,
I2 + 2S2O32– ® S4O62– + 2I–.
В этом случае IO– – промежуточное вещество Вант Гоффа. Если же в качестве катализатора взять молибденовую кислоту, то конечным продуктом её будут сульфат ионы и вода:
MoO4 + 4H2O2 ® [MoO8]2– + 4H2O,
[MoO8]2– + S2O32– +H2O ® 2SO42– + 2H+ + [MoO4]2–,
причём [MoO8]2– – является промежуточным веществом Аррениуса.
Вопросы для самоконтроля
1. Какова роль энтропии активации в каталитической реакции? В каких случаях наблюдаются положительные или отрицательные значения энтропии активации в катализе?
2. Приведите примеры стадийного механизма каталитических реакций. В каком из двух механизмов энергии активации каталитических процессов имеют, как правило, более высокие значения? Ответ поясните
3. Приведите возможные механизмы каталитических процессов, если в отсутствие катализатора реакции протекают по схемам:
а) А→Р; б) А + В →Р; в) А + В →Р1 + Р2.
Дата добавления: 2016-01-09; просмотров: 1174;
