Кинетика основного катализа
Решение кинетической задачи рассмотрим на примере реакций специфического основного катализа.
Пусть взаимодействие протонизированного субстрата (SН) и катализатора (ОH–, Н2O, Cl–) протекает следующим образом:
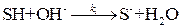 ,
,
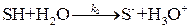 ,
,
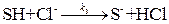 .
.
Каждая из этих стадий может лимитировать скорость протекания всего процесса.
Заключительные стадии процесса являются равновесными, так как протекают значительно быстрее:
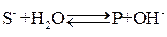 ,
,
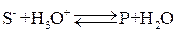 ,
,
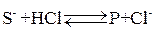 .
.
Таким образом, протонизированный субстрат (SH) взаимодействует с тремя разными катализаторами (параллельные химические реакции), поэтому скорость его расходования будет равна сумме скоростей на отдельных стадиях:
vSH = v1+ v2+ v3
или
vSH= 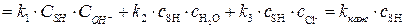 , (5.34)
, (5.34)
где
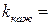
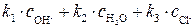 (5.35)
(5.35)
Кажущаяся константа скорости определяется из экспериментальных данных. Изучая, как эта константа меняется от 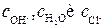 можно оценить каждую из каталитических констант:
можно оценить каждую из каталитических констант: 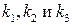 .
.
Примеры решения задач
Пример 1.
Химическая реакция
СН3СООСН3(aq) + Н2O = СН3СООН(aq) + СН3ОН(aq)
катализируется ионами Н+. Полагают, что наблюдаемая константа скорости k' cвязана с константой скорости некаталитической реакции k соотношением:
k' = k(CH+)n. На основании опытных данных определите значения k и п.
| k’·104, с-1 | 0,108 | 0,585 | 1,000 | 2,682 | 3,469 |
| CH+, М | 0,1005 | 0,5024 | 0,8275 | 1,8000 | 2,4290 |
Решение.
После логарифмирования обеих частей уравнения k' = k(cH+)n , получим
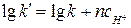 .
.
Это соотношение представляет линейную функцию lgk' от 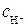 .Если построить график в координатах lgk' –
.Если построить график в координатах lgk' – 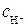 , то отрезок, отсекаемый на оси ординат, равен lgk',а тангенс угла наклона прямой равен п. Численные значения, полученные на основе экспериментальных данных, равны:
, то отрезок, отсекаемый на оси ординат, равен lgk',а тангенс угла наклона прямой равен п. Численные значения, полученные на основе экспериментальных данных, равны:
п= 1,1 » 1 и k·= 1,32·10–4 л·/моль·с.
Пример 2
Установлено, что гидролиз очень разбавленного раствора эфира при 25 °С протекает по кислотно-основному механизму катализа, при этом обратная реакция (этерификации) практически не происходит, эфир растворим в воде и в отсутствие катализатора константа скорости реакции практически равна нулю. Процесс протекает по следующей схеме.
В случае основного катализа:
эфир + ОН– 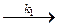 (эфирОН)– (1)
(эфирОН)– (1)
(эфирОН)– +Н2О 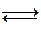 кислота + спирт + ОН– . – быстрая стадия
кислота + спирт + ОН– . – быстрая стадия
В случае кислотного катализа:
эфир + Н+ 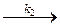 (эфир Н)+ (2)
(эфир Н)+ (2)
(эфир Н)+ + Н2О 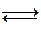 кислота + спирт + Н+ . – быстрая стадия
кислота + спирт + Н+ . – быстрая стадия
Экспериментально показано, что скорость гидролиза эфира практически одинакова для значений рН =1 и рН=9.
Проведите следующие исследования:
а) получите выражение для опытной константы скорости реакции и ответьте на вопрос, зависит ли эта константа от рН раствора;
б) определите, чему равна рН при минимальном значении константы скорости реакции. Какой катализ (ионами Н+ или ОН–) более эффективен в этом случае?
Решение.
а) На основании предложенной схемы лимитирующими стадиями процесса гидролиза являются реакции (1) и (2), поэтому выражение для скорости реакции имеет вид:
v 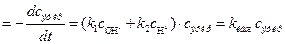 , (3)
, (3)
Откуда кажущаяся константа скорости гидролиза эфира равна:
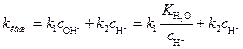 (4)
(4)
где 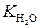 – константа диссоциации воды. При 298 К
– константа диссоциации воды. При 298 К 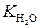 = 10–14.
= 10–14.
Соотношение (4) показывает, что кажущаяся константа скорости реакции 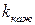 зависит от рН раствора, причем
зависит от рН раствора, причем 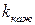 k должна проходить через минимум при условии
k должна проходить через минимум при условии 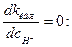
или
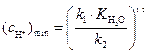 (5)
(5)
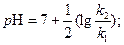 (6)
(6)
б) используя опытные данные, а именно то, что скорость гидролиза эфира практически одинакова для значений рН =1 и рН=9, можно из формулы (4) получить отношение констант 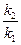 :
:
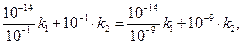 (7)
(7)
откуда
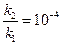 или
или 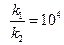 (8)
(8)
Подставляя численное значение отношения 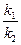 в выражении (6),
в выражении (6),
легко вычисляем значение рН раствора в точке минимума кажущейся константы скорости
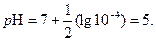 (9)
(9)
Полученный результат объясняет, почему эфиры хранят, например, в парфюмерии при рН = 5.
Дата добавления: 2016-01-09; просмотров: 1567;
