Катализ комплексными соединениями
В этом виде катализа катализаторами чаще всего служат комплексные соединения катионов переходных металлов. Реакции восстановления, гидрирования, окисления, гидратации ненасыщенных соединений, изомеризации, полимеризации и многие другие в промышленных условиях осуществляются в растворах в присутствии комплексных катализаторов.
Механизм их каталитического действия интересен для понимания не только гомогенного, но и гетерогенного катализа. Как известно, к переходным металлам относятся элементы дополнительных подгрупп, они занимают средние части длинных периодов периодической системы от скандия до никеля, от иттрия до палладия и от лантана до платины. К ним же относятся все актиниды. Наиболее широко используются металлы VIII группы Fe, Co, Ni, Rn, Rh, Pd, Os, Ir, Pt, а также Cu, Ag, Hg, Cr и Mn. Для них характерна незавершенность d-оболочки и наличие нескольких валентных состояний.
Сущность каталитического действия заключается в том, что ионы металлов с d-электронной конфигурацией (d6 – d10) могут взаимодействовать с другими молекулами, выступая как акцепторы электронов, принимая электроны на свободные d-орбитали, и как доноры электронов. Ионы переходных металлов, являясь комплексообразователями, могут взаимодействовать с несколькими лигандами, число их, координирующихся около иона металла (координационное число), зависит от электронной конфигурации иона металла и строения лиганда. В реакциях, катализируемых комплексными ионами, молекулы реагентов выступают как лиганды по отношению к иону металла. Химическое взаимодействие реагентов облегчается благодаря поляризации молекул, понижению энергии отдельных связей и повышению вероятности оптимального расположения реагирующих молекул. Центральный ион металла играет роль мостика, облегчающего электронные переходы между реагирующими молекулами. Каталитическая активность иона металла зависит от энергии связи иона с участниками реакции, нежелательны при этом крайние случаи слишком сильной или слабой связи. Являясь донорами или акцепторами электронов, лиганды могут существенно влиять на распределение электронной плотности в реагирующих молекулах, вошедших вместе с ними в состав комплекса, и изменять энергию отдельных связей. Это позволяет регулировать каталитическую активность ионов введением в координационную сферу лигандов определенного строения. Координационно насыщенные комплексы не являются активными катализаторами.
Примером интересных катализаторов гомогенных реакций в растворах являются карбонилы металлов. Они представляют собой комплексные соединения, образованные из электродонорных групп СО и переходных металлов-акцепторов электронов. Атомы металлов – комплексообразователей способны присоединять такое число электронов, какое недостает до построения соответствующего атома инертного газа. Технически важным примером таких реакций служит оксосинтез, или процесс гидроформилирования, метод получения альдегидов из олефинов при взаимодействии жидкого субстрата, соли кобольта, окиси углерода и водорода.
Так, гидрокарбонил никеля не обладает кислыми свойствами, гидрокарбонил железа близок по силе к уксусной кислоте, а гидрокарбонил кобальта является сильной кислотой. В реакции оксосинтеза гидрокарбонил кобальта в 106 раз активнее карбонила железа, а гидрокарбонил совсем неактивен, сюда же относятся карбонилы марганца, вольфрама, хрома, молибдена.
Другой интересной и практически важной реакцией, в которой также существенную роль играют p-комплексы, является реакция окисления этилена до ацетальдегида в водном растворе палладия, так называемый вакер – процесс:
[PdCI4 ]2- + C2H4 + H2O = CH3CHO + Pd + 4Cl- + 2H+.
Металлический палладий легко окисляется до Pd2 двухвалентной медью, а возникающая одновалентная медь окисляется воздухом до Cu2 + :
4CI - +Pd + 2Cu2 + = [PdCI 4]2- + 2Cu+,
4Cu+ +O2 + 4H+ = 4Cu2++ 2H2O.
Таким образом, в ходе реакции расходуются только этилен и кислород.
Хлористый палладий катализирует окисление пропилена до ацетона, окисление цис- и транс- бутенов до метилэтилкетона, реакцию винилирования при взаимодействии этилена и уксусной кислоты в присутствии PdCI2 и Na2HPO4.Характерной реакцией ацетиленов является гидротация , которая катализируется солями Нg(II) в кислых растворах ( реакция Кучерова ):
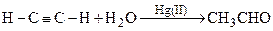 .
.
Подобно олефинам, ацетилен образует p-комплексы со многими ионами переходных металлов, такими как Ag(I), Hg(II).
Важным примером гомогенных каталитических реакций с участием комплексов переходных металлов, в ходе которых образуется p-комплексы с олефинами, являются реакции полимеризации олефинов. Катализаторы для полимеризации предложены Цинглеом и Ната. Их получают из металлорганических соединений элементов II и III групп, чаще всего используют триалкилалюминий. Механизм реакции полимеризации достаточно сложен и малоизучен.
Вопросы для самоконтроля
1. Что называется кислотой по теории Аррениуса? Приведите примеры. Перечислите недостатки теории электролитической диссоциации.
2. Дайте определения кислот и оснований по Бренстеду. Какие соединения называются сопряженными? В чем заключается отличие протонной теории от теории Аррениуса?
3. Дайте определение и приведите примеры кислот и оснований Льюиса. Каковы недостатки этой теории?
4. Сформулируйте определения кислот и оснований по Усановичу. Приведите примеры
5. Какой принцип классификации используется в кислотно–основном катализе? Приведите механизмы катализа, характеризующие его различные типы.
Дата добавления: 2016-01-09; просмотров: 1097;
