В. Реакции, катализируемые синтетазой ВЖК
Биосинтез жирных кислот – циклическое повторение отдельных ферментативных реакций на мультиферментном комплексе, образованном шестью ферментами и ацилпереносящим белком (АПБ), который тоже является ферментом, находящимся в центре. Поэтому часто принимают мультиферментный комплекс (синтетазу высших жирных кислот), состоящий из семи ферментов.
Синтетаза высших жирных кислот (синтаза высших жирных кислот) - полифункциональный комплекс у высокоорганизованных форм имеет молекулярную массу 400 000-560 000 Да. Синтаза высших жирных кислот позвоночных состоит из двух идентичных полипептидных цепей, то есть представляет собой димер. Каждая из цепей (мономеров) длиной около 2300 аминокислотных остатков образует в третичной структуре три домена и в их составе 7 субдоменов, одним из которых является ацилпереносящий белок (АПБ), а шести остальным присуща определенная ферментативная функция (рис.13).
В каждый из двух мономеров в составе соответствующих доменов входят следующие ферменты (субдомены):
1) β-кетоацилсинтаза (конденсирующий фермент);
2) трансацилаза (сочетает две активности: ацилтрансферазы и малонил- трансферазы);
3) β-кетоацилредуктаза;
4) β-оксиацилдегидратаза;
5) еноилредуктаза;
6) тиоэстераза (принимает участие только на заключительной стадии синтеза пальмитиновой кислоты).
Ацилпереносящий белок (АПБ) служит «якорем», к SH-группе которого в ходе удлинения цепи жирной кислоты прикрепляются ацильные промежуточные продукты.
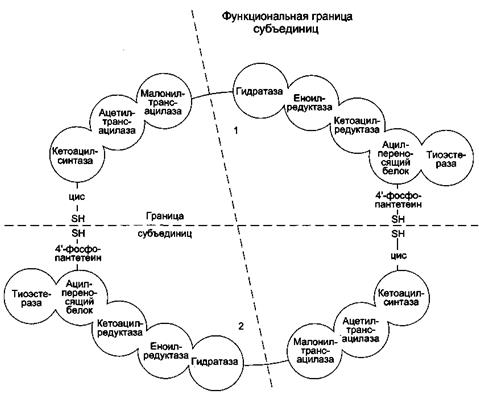
Рис.13. Синтетаза ВЖК
Примечание: Комплекс — димер из двух идентичных полипептидных цепей, каждый из которых имеет 7 активных центров и ацилпереносящий белок (АПБ). SH-группы протомеров принадлежат различным радикалам. Одна SH-группа принадлежит цистеину, другая — остатку фосфопантетеиновой кислоты. SH-группа цистеина одного мономера расположена рядом с SH-группой 4-фосфопантетеината другого протомера. Таким образом, протомеры фермента расположены «голова к хвосту». Хотя каждый мономер содержит все каталитические центры, функционально активен комплекс из 2 протомеров. Поэтому реально синтезируются одновременно 2 жирных кислоты. Для упрощения в схемах обычно изображают последовательность реакций при синтезе одной молекулы кислоты.
Специфическая SH-группа тиоламина АПБ входит в состав 4/-фосфопантотеновой простетической группы, включающей витамин В3, то есть АПБ снабжен своеобразной вращающей «ручкой», торчащей наружу из центральной части комплекса. Она перемещает промежуточные соединения от одного фермента к другому (рис.14).
4/-Фосфопантотеин




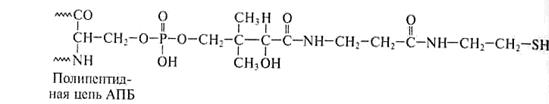
Пантотеновая кислота
Рис.14. Строение «ручки» (простетической группы) АПБ
Каждый из двух мономеров синтетазы хотя и включает все семь субдоменов, участвующих в биосинтезе жирных кислот, однако не является функциональной единицей синтазы. В состав функциональной единицы синтазы входят субдомены обоих мономеров: два одного и пять другого, что показано пунктиром на рис.13.
Синтез на мультиферментном комплексе начинается с переноса ацетильной группы CH3CO~SKoA и малонильной группы HOOC-CH2CO ~ SKoA на сульфгидрильную группу АПБ:
1)Перенос ацильного остатка из CH3CO ~ SKoA на HS-группу β-кетоацил-синтазы (Еконд) на первом (одном из двух) мономере катализируется ферментом ацетил-КоА-трансферазой(трансацилазы):
CH3CO ~ SKoA + HSАПБ → CH3CO ~ SАПБ + HS~KoA
2)На следующей стадии «ручка» АПБ второго мономера принимает на себя малонил из малонил-КоА под действием фермента малонил-КоА-трансферазы (трансацилазы):
HOOC-CH2CO ~ SKoA + HS~АПБ → HOOC-CН2-CO ~ SАПБ + HS~KoA
3)Третья стадия является стадией конденсации. Ацетильный и малонильный остатки, связанные каждый с АПБ, взаимодействуют между собой (конденсируются) с выделением углекислого газа и образованием ацетоацетил-SАПБ (β-кетобутирил-SАПБ). Реакция катализируется
β-кетоацил-АПБ-синтетазой. Реакция конденсации является высоко экзергоничной реакцией:
CH3CO~SAПБ + HOOC-CH2CO~SAПБ → CO2 + CH3COCH2CO~SAПБ + HS~AПБ β-кетобутирил-SАПБ
Ацетил-Еконд и малонил-АПБ на первом мономере реагируют друг с другом таким образом, что ацетильная группа ацетил-Еконд доставляет 3-й и 4-й атомы углерода для ацетоацетильной группы β-кетобутирил-АПБ. В результате этой реакции из свободной карбоксильной группы малонил-АПБ высвобождается СО2.
Образующаяся молекула СО2 содержит тот же атом углерода, который включился в малонил-АПБ в процессе ацетил-КоА-карбоксилазной реакции. Оксид углерода (IV) в синтезе высших жирных кислот играет роль катализатора, поскольку он удаляется сразу же после того, как встраивается каждая следующая двууглеродная единица. Декарбоксилирование малонила позволяет реакции пройти до конца и является движущей силой биосинтеза жирных кислот.
4)На четвертой стадии β-кетобутирил-АПБ восстанавливается. Фермент β-кетоацил-АПБ-редуктаза, коферментом которого является восстановленный НАДФН+Н+, превращает β-кетобутирил-АПБ в β-гидроксибутирил-АПБ (β-оксибутирил-АПБ):
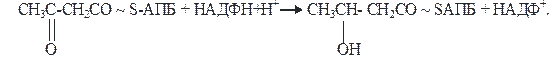
β-кетобутирил-АПБ β-гидроксибутирил-АПБ
5)На пятой стадии образующийся β-оксибутирил-АПБ дегидратируется на втором мономере. Дегидратация приводит к образованию ненасыщенного кротонил-АПБ (еноил-АПБ) при участии фермента β-гидроксиацил-АПБ-дегидратаза:
 CH3CH-CH2-CO~S-АПБ → СH3CH=CHCO~S-АПБ + H2O.
CH3CH-CH2-CO~S-АПБ → СH3CH=CHCO~S-АПБ + H2O.
OH
β-гидроксибутирил-АПБ кротонил-АПБ
6)На шестой стадии происходит восстановление ненасыщенного кротонил-АПБ до бутирил-АПБ, которое катализируется ферментом еноил-АПБ-редуктазой, коферментом которого является НАДФН+Н+:
CH3CH=CH-CO~S-АПБ + НАДФН+Н+ → НАДФ+ + CH3CH2CH2CO ~S-АПБ.
Дата добавления: 2016-01-09; просмотров: 1243;
