Самопроизвольно могут протекать те реакции, в которых восстановитель имеет меньший потенциал, чем окислитель.
Пользуясь этим правилом, нетрудно предсказать, что реакции
Zn + Pb2+ = Zn2+ + Pb
Fe + 2H+ = Fe2+ + H2
должны протекать самопроизвольно, а реакции
Cu + Ni2+ = Cu2+ + Ni
2Ag + 2H+ = 2Ag+ + H2
в прямом направлении протекать не могут.
Электродный равновесный потенциал зависит от следующих основных факторов.
От природы металла. Чем большей химической активностью обладает данный металл, тем в большей степени равновесие (5.1) смещено вправо, тем отрицательнее потенциал.
От концентрации ионов металла в растворе.Переход ионов металла в раствор происходит тем интенсивнее, чем меньше концентрация катионов в растворе. Наоборот, с увеличением концентрации раствора равновесие (5.1) смещается влево и потенциал становится более положительным.
От температуры. С повышением температуры потенциал становится более положительным, т.е. равновесие (5.1) смещается влево.
Зависимость величины потенциала от указанных факторов выражается уравнением Нернста:
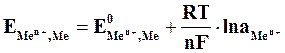 , (5.2)
, (5.2)
где 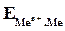 - электродный потенциал металла (Ме) в растворе, содержащем катионы
- электродный потенциал металла (Ме) в растворе, содержащем катионы 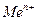 ;
; 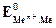 - стандартный или нормальный потенциал рассматриваемой системы; R – универсальная газовая постоянная; Т - температура по шкале Кельвина; n – число электронов, участвующих в электродном процессе; F - число Фарадея; а
- стандартный или нормальный потенциал рассматриваемой системы; R – универсальная газовая постоянная; Т - температура по шкале Кельвина; n – число электронов, участвующих в электродном процессе; F - число Фарадея; а  - активность ионов металла в растворе. Для разбавленных растворов коэффициент активности близок к единице и вместо активности можно пользоваться концентрацией ионов в растворе.
- активность ионов металла в растворе. Для разбавленных растворов коэффициент активности близок к единице и вместо активности можно пользоваться концентрацией ионов в растворе.
Если в уравнение (5.2) подставить значения постоянных R, F, принять температуру для стандартных условий (Т0 = 298К) и перейти от натуральных к десятичным логарифмам, получим:
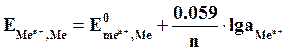 (5.3)
(5.3)
Из уравнения (5.3) следует, что стандартный электродный потенциал (E0) – это потенциал электрода при стандартных условиях: 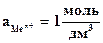 , Т=298 К.
, Т=298 К.
Величина (Е0) характеризует химическую активность металла.
Чтобы выяснить, какой из электродов в гальваническом элементе будет отрицательным (анодом), а какой – положительным (катодом), надо сравнить значения стандартных электродных потенциалов (Е0) . Электрод, у которого стандартный электродный потенциал меньше, станет анодом. Гальванический элемент записывается в виде электрохимической схемы. Слева записывают анод, отделяя его одной вертикальной чертой от раствора, в который он опущен. Двумя вертикальными чертами отделяют одну половинку элемента от другой. Например, электрохимическая схема медно-цинкового элемента Даниэля-Якоби запишется следующим образом:
( - ) Zn │ ZnSO4││CuSO4│Cu ( + )
Чтобы этот элемент заработал надо соединить электроды металлическим проводником, т.е. замкнуть внешнюю цепь:
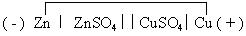
При работе этого элемента на электродах будут идти следующие процессы. На аноде атомы Zn будут отдавать валентные электроны и превращаться в катионы Zn2+, которые перейдут в раствор, а освободившиеся при этом электроны перейдут по внешней цепи на медный катод.
На катоде катионы Cu2+, находящиеся в растворе, заберут эти электроны с катода и превратятся в атомы Cu, т.е. войдут в кристаллическую решетку медного катода.
Если эти процессы записать в виде химических окислительно-восстановительных реакций, то анодный и катодныйпроцессы при работе этого гальванического элемента будут следующими:
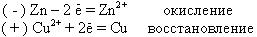
6. Электрохимическая коррозия металлов
При изучении этой темы необходимо выучить физический смысл электрохимической коррозии металлов; разобраться с методами защиты от коррозии.
Электрохимическая коррозия – разрушение металла под действием окружающей среды в результате возникновения микроскопических гальванических элементов (гальванических пар). Используемые в технике металлы, как правило, химически неоднородны, т.е. содержат примеси других металлов. Это является причиной возникновения микроскопических гальванических элементов, при работе которых разрушается (корродирует) более активный металл, т.е. тот, у которого стандартный потенциал (Е0) меньше.
Наиболее распрастранненый коррозионный процесс – ржавление железа. По отношению ко многим примесям (олово, свинец, никель, медь и др.) железо выступает в роли анода, т.к., 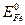 меньше Е0 этих металлов. Например,
меньше Е0 этих металлов. Например,
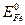 =-0,44В, а
=-0,44В, а 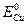 =0,34В. Если опустить такую металлическую пластинку в раствор кислоты, то возникнет короткозамкнутый микрогальванический элемент, анодом которого будет железо:
=0,34В. Если опустить такую металлическую пластинку в раствор кислоты, то возникнет короткозамкнутый микрогальванический элемент, анодом которого будет железо:
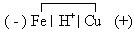
При его работе на аноде и катоде будут следующие реакции:
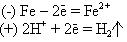
Переход образовавшихся катионов Fe2+ в раствор и есть коррозия. Если доступ ионов Н+ к медному катоду прекратить, то электродные потенциалы
выравниваются, и элемент перестанет работать, т.е. коррозия прекратится.
Катодный процесс в данном случае называют водородной деполяризацией.
В нейтральных средах (в атмосфере) электрохимическая схема этого микрогальванического элемента следующая:
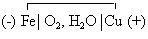
Электродные реакции в этом случае следующие:
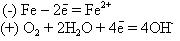
Ионы Fe2+, перешедшие в раствор, соединяются с гидроксид-ионами
Fe2+ + 2OH- = Fe (OH)2
В дальнейшем происходит окисление кислородом воздуха Fe2+ до Fe3+ . Окончательным продуктом окисления является гидратированный оксид железа (ІІІ) – ржавчина.
Дата добавления: 2015-12-08; просмотров: 1515;
