Электропроводность или способность проводить электрический ток любого вещества обратно пропорциональна его электрическому сопротивлению.
Удельная электропроводность является величиной, обратной удельному сопротивлению:
æ 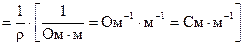 ,
,
где, См - сименс, величина обратная сопротивлению.
По физическому смыслу удельная электропроводность раствора электролита – это проводимость раствора объемом 1м3 при расстоянии между электродами в 1м. Таким образом площадь сечения электродов
должна быть 1м2.Удельная электропроводность растворов электролитов зависит от концентрации и скорости движения ионов в растворе, заряда ионов. С увеличением концентрации электролита электропроводность (æ) увеличивается, достигая определенного максимального значения. При дальнейшем увеличении концентрации (æ) начинает уменьшаться. Такая зависимость очень четко выражена для сильных электролитов и значительно хуже для слабых. Наличие максимума объясняется тем, что в разбавленных растворах сильных электролитов скорость движения ионов почти не зависит от концентрации и (æ) растет почти прямо пропорционально числу ионов, которое увеличивается с концентрацией. При достижении определенной концентрации в растворах сильных электролитов скорость движения ионов существенно уменьшается из-за наличия «ионной атмосферы», в результате чего (æ) также уменьшается. Для слабых электролитов при достижении определенной концентрации начинает уменьшаться степень диссоциации. В результате число ионов в растворе возрастает в меньшей степени, чем аналитическая концентрация раствора, что приводит к уменьшению удельной электропроводности.
Удельная электрическая проводимость не учитывает основной характеристики растворов – концентрации. Поэтому введено понятие молярной электропроводности.
Молярной электрической проводимостью (l) называется электрическая проводимость объема раствора, содержащего 1 кмоль растворенного вещества и помещенного между электродами, находящимися на расстоянии 1м друг от друга.И тогда
l = æ × V.
Концентрация вещества (с) связана с объемом раствора (V), содержащим 1 кмоль электролита, соотношением:
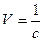 .
.
С учетом концентрации уравнение для молярной электропроводности запишется в виде:
l =  æ /с,
æ /с, 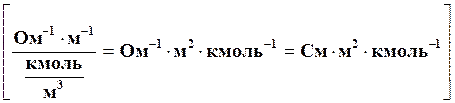
Молярная электропроводность как сильных так и слабых электролитов увеличивается с уменьшением концентрации, т.е. с увеличением разведения раствора, и достигает некоторого предельного значения, называемого молярной электрической проводимостью при бесконечном разбавлении (l∞).
Дата добавления: 2015-12-08; просмотров: 631;
