Примеры решения задач. Пример 1. Установлено, что энергия активации разложения карбамида в присутствии катализатора уреазы уменьшается в четыре раза
Пример 1. Установлено, что энергия активации разложения карбамида в присутствии катализатора уреазы уменьшается в четыре раза. Оценитьпри какой температуре необходимо проводить эту же реакцию разложения, чтобы она протекала с такой же скоростью, как и каталитическая реакция при температуре 298 К?
Решение. Запишем для каталитической реакции в присутствии уреазы уравнение Аррениуса 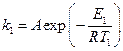 , где Т1, = 298 К;Е1 – энергия активации.
, где Т1, = 298 К;Е1 – энергия активации.
В отсутствие уреазы это уравнение примет вид[3]:
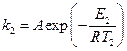 ,
,
где Е2 – энергия активации, отличная, от Е1; Т2 – температура, при которой k2= k1. Приравнивая левые части обоих уравнений, после логарифмирования получим:
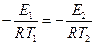 , откуда
, откуда 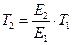 .
.
Подставляя значение 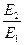 = 4 (дано по условию задачи), находим: Т2= 4·298 = 1192 К (919 °С). Таким образом, для достижения одинаковой с каталитической реакцией скорости требуется значительное повышение температуры по сравнению с 298 К, т.е. существенные затраты энергии.[4]
= 4 (дано по условию задачи), находим: Т2= 4·298 = 1192 К (919 °С). Таким образом, для достижения одинаковой с каталитической реакцией скорости требуется значительное повышение температуры по сравнению с 298 К, т.е. существенные затраты энергии.[4]
Пример 2. Для некоторой химической реакции присутствие катализатора позволяет уменьшить энергию активации химического процесса, реализуемого при температуре 500 °С, от 50 до 35 кДж. Покажем:
а) во сколько раз увеличится скорость каталитической реакции по сравнению с некаталитической, полагая, что все другие факторы скорости реакции остаются неизменными;
б) при какой температуре каталитическая реакция протекала бы с такой же скоростью, что и некаталитическая при 500 °С;
в) какие преимущества дает использование катализатора?
Решение.
а) Пусть для некаталитической реакции уравнение Аррениуса имеет вид:
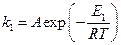 , (1)
, (1)
В присутствие катализатора это уравнение имеет вид:
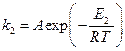 . (2)
. (2)
Если поделим уравнение (1) на уравнение (2), то после логарифмирования получим:
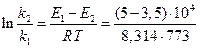 = 2,3; откуда
= 2,3; откуда 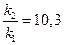 и
и 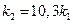 ;
;
Используем уравнение Аррениуса, связывающее кинетические параметры следующим
б) найдем температуру, при которой k2будет иметь такое же значение, что и k1при 500 °С (или 773 К). Это означает, что надо найти температуру Т2,для которой 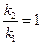 и
и 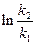 = 0.
= 0.
То есть
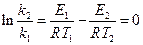 , откуда
, откуда 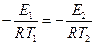
или
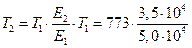 =541,1 К(261,8) °С;
=541,1 К(261,8) °С;
в) использование катализатора позволяет понизить температуру, не уменьшая скорости процесса, что приведет к экономии энергии (особенно это важно для промышленных процессов).
Пример 3.Экспериментально установлено, что реакция
2Се4+ + Тl = 2Се3+ + Т13+ (1)
протекает в растворе очень медленно, но ускоряется в присутствии ионов Ag+, причем скорость становится пропорциональной концентрации ионов Ag+. На основании предложенного механизма для этой реакции
Ag++ Се4+  Ag2+ + Се3+, (1a)
Ag2+ + Се3+, (1a)
Ag2+ + Tl+  Ag+ + Tl2+, (2)
Ag+ + Tl2+, (2)
Tl2+ + Се4+  Tl3+ + Се3+, (3)
Tl3+ + Се3+, (3)
Необходимо вывести кинетическое уравнение для образования продукта реакции (1), ионов Т13+.
Решение.
Скорость образования продукта Т13+ можно записать как
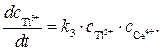 (4)
(4)
Ион Т12+образуется только по стадии (2) и вступает в реакцию лишь на стадии (3), поэтому скорости этих двух стадий выравниваются, т.е.
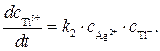 (5)
(5)
Концентрацию другого промежуточного соединения, Ag2+, находим, используя принцип квазистационарных концентраций:
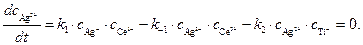 (6)
(6)
Подставляя значение 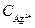 из выражения (6) в уравнение (4), получим
из выражения (6) в уравнение (4), получим
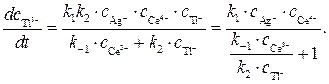 (7)
(7)
Значение отношения констант 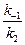 в начальный период реакции таково, что в знаменателе никакой член не является доминирующим, это не позволяет провести аппроксимацию. Но на последних стадиях реакции первый член становится преобладающим, т.е. единицей можно пренебречь, и выражение для скорости аппроксимируется к виду
в начальный период реакции таково, что в знаменателе никакой член не является доминирующим, это не позволяет провести аппроксимацию. Но на последних стадиях реакции первый член становится преобладающим, т.е. единицей можно пренебречь, и выражение для скорости аппроксимируется к виду
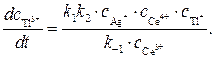 (8)
(8)
Полученное кинетическое уравнение подтверждает опытный факт прямо пропорциональной зависимости скорости образования продуктов от концентрации катализатора — ионов Ag+.
Вопросы для самоконтроля
1. Дайте классические определения терминов «катализ» и «катализатор». Являются ли теплота и свет катализаторами?
2. Оказывает ли катализатор влияние на термодинамические условия процесса? Смещает ли он положение равновесия? Может ли он изменить выход продукта реакции? Ответ объясните.
3. В чем заключается причина увеличения скорости химической реакции в присутствии катализатора?
Дата добавления: 2016-01-09; просмотров: 4123;
