Основной постулат химической кинетики. Закон действующих масс
При заданных внешних условиях (температура, давление, среда, в которой происходит процесс) скорость химического превращения является функцией только концентрации реагентов. Уравнение, описывающее зависимость скорости химической реакции от концентрации реагентов 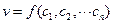 называется кинетическим уравнением реакции. В зависимости от реакции функция
называется кинетическим уравнением реакции. В зависимости от реакции функция 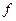 может быть более или менее сложной. Для вывода вида этой кинетической зависимости рассмотрим вначале одностороннюю элементарную бимолекулярную реакцию
может быть более или менее сложной. Для вывода вида этой кинетической зависимости рассмотрим вначале одностороннюю элементарную бимолекулярную реакцию
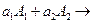 продукты (4.14)
продукты (4.14)
Все молекулы исходных веществ, участвующие в реакции, суммарная энергия которых превышает на величину энергии активации и более их суммарную энергию в исходном состоянии, преодолеют при сближении (столкновении) энергетический барьер и прореагируют с образованием продуктов реакции. Доля таких прореагировавших молекул будет пропорциональна вероятности их столкновения. А эта вероятность, как вероятность сложного события, пропорциональна произведению вероятностей того, что молекулы одновременно столкнутся в данной точке реакционного пространства. С другой стороны, вероятность нахождения частицы в данной точке пространства будет пропорциональна числу частиц в объеме, т. е. концентрации. Вероятность одновременного присутствия реагирующих молекул в одной и той же точке пространства будет пропорциональна произведению их концентраций.
Из приведенных рассуждений следует, что при постоянной температуре скорость элементарной химической реакции в каждый момент времени пропорциональна произведению текущих концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам в уравнении реакции.
Это положение – основной постулат химической кинетики был сформулирован Гульдбергом и Вааге в 1867 году и получил название закона действующих масс.
Закон действующих масс применим к любой элементарной стадии сложной реакции, а также к описанию некоторых сложных реакций.
Если химическая реакция протекает в одну элементарную стадию, то ее кинетическое уравнение, связывающее скорость реакции с концентрацией реагирующих веществ, может быть написано непосредственно по ее химическому уравнению.
Для элементарной химической реакции (1) основной постулат химической кинетики запишется
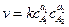 . (4.15)
. (4.15)
Если элементарная химическая реакция протекает между двумя одинаковыми молекулами А по реакции 
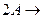 продукты, то скорость реакции равна
продукты, то скорость реакции равна 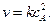
Для любой элементарной реакции
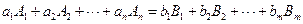
основной постулат химической кинетики запишется:
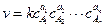 , (4.16)
, (4.16)
где 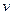 — скорость элементарной реакции;
— скорость элементарной реакции; 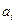 - стехиометрические коэффициенты;
- стехиометрические коэффициенты; 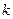 — константа скорости реакции.
— константа скорости реакции.
Константа скорости реакции численно равна скорости реакции при концентрации реагирующих веществ, равных 1.
Константу скорости реакции иногда называют удельной скоростью реакции. Константа скорости реакции 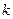 не зависит от концентрации реагентов и времени протекания процесса, но зависит от температуры.
не зависит от концентрации реагентов и времени протекания процесса, но зависит от температуры.
Показатели степени 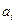 в уравнении (4.16) называют порядком реакции по веществам Ai соответственно. Сумму порядков по всем веществам называют общим порядком реакции или просто порядком реакции.
в уравнении (4.16) называют порядком реакции по веществам Ai соответственно. Сумму порядков по всем веществам называют общим порядком реакции или просто порядком реакции.
Для обратимой реакции, если скорости прямой и обратной реакции в изучаемом диапазоне условий соизмеримы, выражение суммарной, наблюдаемой на опыте скорости запишется в виде разности скоростей прямой и обратной реакций
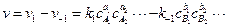 ,
,
где 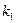 и
и 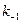 константы скорости прямой и обратной реакций. При термодинамическом равновесии скорости прямой и обратной реакций становятся равными, а общая скорость реакции
константы скорости прямой и обратной реакций. При термодинамическом равновесии скорости прямой и обратной реакций становятся равными, а общая скорость реакции 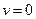 и, следовательно
и, следовательно
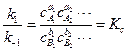 , (4.17)
, (4.17)
где 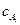 и
и 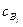 - равновесные концентрации реагентов.
- равновесные концентрации реагентов.
Таким образом, если реакция протекает обратимо, то отношение констант скоростей прямой и обратной реакций равно константе равновесия химической реакции.
В ряде случаев одним стехиометрическим уравнением вида
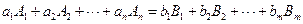
может быть описана сложная реакция, состоящая из нескольких разнотипных элементарных стадий. Это возможно, если реакция протекает с участием лабильных промежуточных веществ, то есть промежуточных веществ, концентрация которых на протяжении всего процесса пренебрежимо мала по сравнению с концентрацией исходных веществ и продуктов реакции. При этом скоростями побочных превращений этих промежуточных веществ можно пренебречь по сравнению со скоростью основного превращения. Кинетическое уравнение таких сложных реакций, в определенном диапазоне условий, с достаточной степенью точности может быть записано в виде
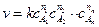 , (4.18)
, (4.18)
Такие реакции называются формально простыми. В широком смысле, к формально простым реакциям относятся любые сложные реакции, для которых кинетическое уравнение в требуемом интервале изменения концентраций может быть получено на опыте в виде степенной зависимости (4.15). Кинетическое выражение типа (4.15) для формально простых реакций имеет значение, тогда когда целью исследования является установление формального уравнения для скорости реакции в виде степенной функции.
Если реакция протекает в газовой фазе, то уравнение формальной кинетики можно записать:
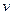 = k×
= k× 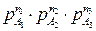 ,(4.19)
,(4.19)
где n1, n2, n3– порядки реакции по веществам А1, А2 и А3 (частные порядки реакций); n = n1+ n2+ n3 – общий порядок реакции, а 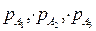 – парциальные давления реагентов.
– парциальные давления реагентов.
Уравнения вида (4.18) и (4.19) называются кинетическими уравнениями.
Размерность константы 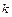 зависит от способа выражения скорости реакции и от ее общей молекулярности. Если скорость реакции выражена в
зависит от способа выражения скорости реакции и от ее общей молекулярности. Если скорость реакции выражена в 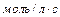 , а концентрация в
, а концентрация в 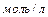 , то для мономолекулярной реакции размерность
, то для мономолекулярной реакции размерность 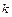 соответствует
соответствует 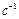 , для бимолекулярной реакции -
, для бимолекулярной реакции - 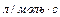 .
.
Значения n1, n2, n3 могут быть не равны стехиометрическим коэффициентам в уравнении реакции. Они могут принимать значения 0, 1, 2 и т. д., быть дробными и отрицательными. Например, для реакции: А + В→С скорость реакции по веществу С, определенная экспериментально, имеет вид: 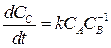 . Это говорит о том, что с ростом концентрации вещества В скорость образования вещества С уменьшается.
. Это говорит о том, что с ростом концентрации вещества В скорость образования вещества С уменьшается.
Дробный порядок реакции, определенный по экспериментальным данным, указывает на сложный механизм протекания реакции.
Если реакция протекает при избытке какого то реагента, то порядок реакции по этому реагенту будет равен нулю, так как изменение его концентрации не будет оказывать влияние на скорость реакции.
Например, реакция взаимодействия монохлоруксусной кислоты с водой
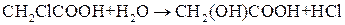
является бимолекулярной реакцией. Если этот процесс проводить в избытке воды, то скорость этой реакции будет зависеть только от концентрации монохлоруксусной кислоты, то есть с кинетической точки зрения это реакция первого порядка.
Порядок реакции – это величина формальная. Его значение сильно зависит от механизма процесса. Поэтому факторы, влияющие на механизм процесса (температура, концентрация веществ, наличие катализатора и др), могут влиять и на величину порядка реакции. Например, скорость реакции йодирования ацетона
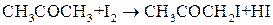
при стехиометрических соотношениях реагентов не зависит от концентрации йода и потому является реакцией первого порядка. Причиной такого явления является тот факт, что данная химическая реакция протекает в две стадии:
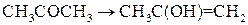 (1)
(1)
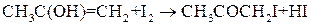 (2)
(2)
Скорость первой стадии намного меньше скорости второй стадии, которая в условиях эксперимента протекает практически мгновенно. В итоге, скорость реакции иодирования ацетона определяется только закономерностями первой (лимитирующей) стадией процесса и является реакцией первого порядка.
При небольших концентрациях йода скорость реакции иодирования ацетона
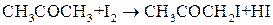
зависит уже как от концентрации ацетона, так и от концентрации йода и порядок этой реакции равен двум.
Постоянство частных порядков реакции при всех концентрациях реагентов, т.е. от начального момента реакции до ее завершения, характерно лишь для одностадийных односторонних реакций. Для сложных реакций при значительном изменении концентрации реагентов постоянство частных порядков нередко нарушается.
Понятий «порядок реакции» и «молекулярность реакции» отличаются друг от друга. Это отличие можно свести к следующему:
1) молекулярность имеет вполне определенный физический смысл, а порядок реакции – это величина формальная;
2) понятие «порядок» реакции можно использовать для любых реакций, как сложных, так и элементарных. Понятие «молекулярность реакции» применимо только к элементарным актам химических превращений;
3) порядок реакции может принимать любые значения: целые, дробные. и даже отрицательные, численные значения молекулярности ограничены цифрами 1,2 и 3.
Вопросы и задания для самоконтроля
1. Что изучает химическая кинетика?
2. Каким соотношением связаны изменение количества реагирующего вещества и химическая переменная?
3. Приведите выражение скорости реакции через химическую переменную. Какой вывод оно позволяет сделать?
4. В чем заключается различие понятий «порядок» и «молекулярность» химической реакции? В каком случае эти величины могут быть численно равны?
5. Укажите порядок данной реакции по каждому веществу и общий порядок реакции:
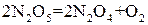 .
.
На основе метода формальной кинетики запишите уравнение, связывающее общую скорость реакции со скоростями по отдельным веществам.
6. Физический смысл константы скорости реакции. От каких параметров она зависит?
Дата добавления: 2016-01-09; просмотров: 2176;
