Скорость химических реакций в закрытых системах
Закрытой называется система, которая не обменивается веществом с окружающей средой, но может обмениваться энергией.
В закрытой системе изменение количества i-го вещества с течением времени происходит только за счет протекания в ней химической реакции. Закрытой системе в химической технологии соответствует периодический процесс, например, в автоклавах.
При протекании гомогенной реакции в закрытой системе объем системы в ходе реакции не изменяется. Поэтому, в уравнении (4.1) для скорости реакции по i-му веществу, его можно ввести под знак дифференциала. Тогда, учитывая что 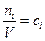 , получим
, получим
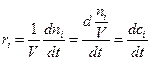 (4.2)
(4.2)
Если в реакции участвует несколько веществ, то скорость реакции можно выражать через концентрацию любого из них.
Запишем химическое уравнение элементарной реакции в общем виде
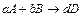 ,
,
где А и В - реагенты, D – продукт реакции, a, b и d – стехиометрические коэффициенты.
Уравнение химической реакции есть уравнение материального баланса. В каждом элементарном акте этой реакции, а частиц (молекул, атомов и пр.) реагента А реагирует с b частицами реагента В. При этом образуется d частиц продукта D.
Скорости реакций по каждому из веществ не всегда одинаковы. Например, скорость реакции по кислороду в реакции 2 H2O2 ® 2 H2O + O2 будет в два раза меньше, чем скорость реакции определяемая по H2O2 и по H2O.
Если химическая реакция может быть выражена одним уравнением, то в закрытой системе изменения количеств каждого из реагентов не является независимым, а связаны между собой стехиометрическими соотношениями. Так для реакции

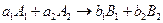
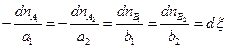 , (4.3)
, (4.3)
где 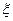 - химическая переменная (глубина протекания реакции). Размерность
- химическая переменная (глубина протекания реакции). Размерность 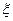 в системе СИ - моль. Так как количество исходных веществ в ходе реакции уменьшается, то
в системе СИ - моль. Так как количество исходных веществ в ходе реакции уменьшается, то 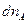 и
и 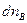 имеют знак минус.
имеют знак минус.
Таким образом, при любом числе участников реакции перераспределение масс в системе можно описать с помощью единственной переменной 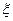 , дифференциал которой может быть определен с помощью любого из написанных выше соотношений. Уравнение (4.3) позволяет вычислить значение глубины протекания реакции
, дифференциал которой может быть определен с помощью любого из написанных выше соотношений. Уравнение (4.3) позволяет вычислить значение глубины протекания реакции 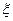 ко времени t на основании измерения изменения количества только одного компонента, присутствующего в реакционной смеси. Очевидно, на опыте выбирают компонент, наиболее легко определяемый аналитически (одно из исходных веществ или один из продуктов реакции)
ко времени t на основании измерения изменения количества только одного компонента, присутствующего в реакционной смеси. Очевидно, на опыте выбирают компонент, наиболее легко определяемый аналитически (одно из исходных веществ или один из продуктов реакции)
Между скоростями образования и расходования реагентов в приведенной выше реакции существует соотношение:
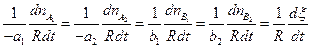 .
.
Отсюда следует, что величина
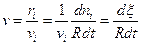 (4.4)
(4.4)
называемая скоростью реакции, не зависит от выбора реагента и является однозначной характеристикой скорости реакции в целом. 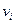 -стехиометрические коэффициенты.
-стехиометрические коэффициенты.
2. Скорость реакции – это число элементарных актов или изменение количества вещества (исходного или продукта) в единицу времени в единице реакционного про-странства (R), рассчитанное на единицу его стехиометрического коэффициента ( 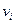 ):
):
Скорость реакции не зависит от выбора реагента, всегда положительна, поэтому для исходных веществ ( 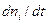 < 0) стехиометрический коэффициент нужно брать со знаком минус потому, что концентрации этих веществ в ходе реакции убывают, а для продуктов реакции (
< 0) стехиометрический коэффициент нужно брать со знаком минус потому, что концентрации этих веществ в ходе реакции убывают, а для продуктов реакции ( 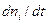 > 0) – со знаком плюс.
> 0) – со знаком плюс.
Выражение для скорости гомогенной реакции в закрытой системе (RºV= const) запишется
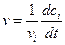 . (4.5)
. (4.5)
Размерность скорости реакции ( 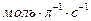 ), (
), ( 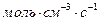 ) или (
) или ( 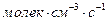 ).
).
Выражение для скорости гетерогенной реакции (RºS=const) запишется:
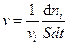 . (4.6)
. (4.6)
Размерность скорости реакции в этом случае: ( 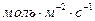 ), (
), ( 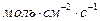 ) или (
) или ( 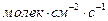 ).
).
В случае протекания сложных химических реакций скорость по веществу — это алгебраическая сумма скоростей получения и расходования данного вещества на отдельных стадиях этого процесса (принцип независимости протекания реакций):
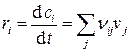 , (4.7)
, (4.7)
где ri — скорость реакции по i-му веществу, vj — скорость j-й стадии,
nij — стехиометрический коэффициент i-го вещества в j-й стадии.
Например, для реакции
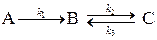
скорость по веществу В будет равна:
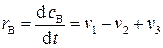 .
.
Для реакций, протекающих в газовой фазе, скорость можно определять через парциальные давления веществ.
В химической кинетике концентрацию чаще всего выражают в моль/дм3 или 1/см3 (число молекул в кубическом сантиметре). Время же может измеряться в любых единицах (с, мин, ч, столетия и др.). Для газовой фазы иногда используют единицы давления (Па, торр и атм). Поэтому, размерность скорости может быть записана как: моль/(дм3 · [время]), 1/(см3 · [время]) или Па/[время].
3. Истинная или начальная скорость реакции – это скорость реакции в начальный момент времени (t®0, Dt®0), которая за очень короткий промежуток времени остается практически неизменной:
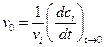 .
.
Дата добавления: 2016-01-09; просмотров: 1119;
