Примеры решения задач. Пример 1.Вычислить термодинамические параметры (DG° , DA°, DS°, DH°, DU°) химической реакции
Пример 1.Вычислить термодинамические параметры (DG° , DA°, DS°, DH°, DU°) химической реакции
Cd + Hg2SO4= 2 Hg + CdSO4,
осуществляемой при работе нормального элемента Вестона. Зависимость ЭДС этого элемента от температуры выражается уравнением:
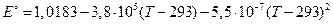 .
.
Решение.Нормальный элемент Вестона представляет собой электрохимический элемент
(-) Сd(Hg), CdSO4·8/3 H2O½CdSO4aq нас. ½Hg2SO4, Hg (+)
Покажем, что итогом работы этого элемента является химическая реакция, записанная в условии задачи.
Реакции, протекающие на электродах:
а) на отрицательном Cd = Cd2+ + 2e;
б) на положительном Hg2SO4 + 2e = 2Hg + SO42-.
Cуммарная реакция, протекающая в гальваническом элементе:
Сd + Hg2SO4 = Cd2+ + 2Hg + SO42-.
Как видно, эта реакция идентична изучаемой.
Значение DG° находим по формуле (3.56), учитывая, что z = 2 (число электронов, принимающих участие в реакциях) и Т=298 К:
DG° = – 2×96485×(1,0183 – 3,8×10-5×5 – 6,5.10-7×52) = – 196497,5 Дж .
DG° = – 196,5 кДж.
Отрицательное значение энергии Гиббса указывает на то, что, при постоянном давлении и температуре, при работе нормального элемента Вестона процесс протекает самопроизвольно.
Для вычисления энергии Гельмгольца DА° используем выражение (3.57). Поскольку в электрохимической реакции, протекающей в элементе, газообразные вещества не участвуют, то Dn=0. Следовательно,
DA° = DG° = – 196,5 кДж.
Чтобы оценить значения DS° и DH°, необходимо определить температурный коэффициент ЭДС электрохимического элемента. Для этого продифференцируем по температуре уравнение зависимости Е от Т:
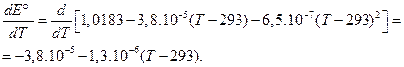
Таким образом, значение температурного коэффициента ЭДС при 298 К равно:
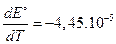 В/К.
В/К.
Изменение энтропии в ходе реакции определяем по формуле (3.59)
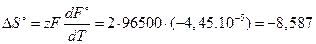 Дж/К.
Дж/К.
Тепловой эффект данной химической реакции с учетом формулы (3.62) равен:
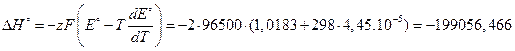 Дж;
Дж;
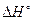 = –199,06 кДж.
= –199,06 кДж.
Полученный результат показывает, что реакция в электрохимическом элементе протекает с выделением тепла.
Изменение внутренней энергии определяется по формуле (3.61). Поскольку среди компонентов электрохимической реакции, протекающей в элементе, нет газообразных веществ (Dn=0), следовательно
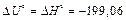 кДж.
кДж.
Пример 2.Гальванический элемент
(–) Hg, Hg2Cl2 ½ KCl aq. ║ MnO 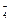 , Mn2+, H+ ½ Pt (+) ;
, Mn2+, H+ ½ Pt (+) ;
использован для определения рН раствора. Если активность ионов MnO 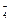 и Mn2+ равны 0,1 М и 0,01 М соответственно, то ЭДС этого элемента равна 1,07 В. Стандартный потенциал электрода MnO
и Mn2+ равны 0,1 М и 0,01 М соответственно, то ЭДС этого элемента равна 1,07 В. Стандартный потенциал электрода MnO 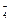 , Mn2+, H+½Pt равен 1,52 В. Потенциал каломельного электрода (CKCl=1моль/л), использованного в работе, равен 0,28 В. Необходимо определить рН раствора, содержащего ионы марганца.
, Mn2+, H+½Pt равен 1,52 В. Потенциал каломельного электрода (CKCl=1моль/л), использованного в работе, равен 0,28 В. Необходимо определить рН раствора, содержащего ионы марганца.
Решение.Запишемэлектродную реакцию и потенциал положительного электрода:
MnO 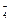 + 8 H+ + 5e ® Mn2+ + 4 H2O;
+ 8 H+ + 5e ® Mn2+ + 4 H2O;
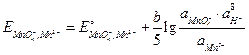 ;
;
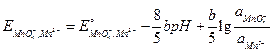
ЭДС элемента равна разности потенциалов положительного и отрицательного электродов:
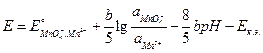
Откуда рН раствора равно:
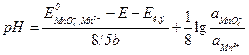 ;
;
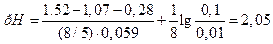 .
.
Пример 3.ЭДС элемента при 298 К равна 0,72 В. Средний коэффициент активности KI в 1 М растворе равен 0,65, а средний коэффициент активности AgNO3 в 0,001 М растворе равен 0,98. Каково произведение растворимости соли AgI? Какова растворимость соли AgI в чистой воде?
Решение.Составляем гальванический элемент
(–) Ag, AgI½KI aq. ║ AgNO3 aq. ½ Ag (+)
c' = 1 M; c"=0,001 M.
Этот элемент можно рассматривать как концентрационный по отношению к ионам серебра в каждом из растворов.
По ЭДС этого элемента можно вычислить произведение растворимости малорастворимой соли:
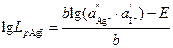 ,
,
где 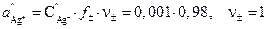 ;
;
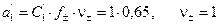 ,
,
тогда:
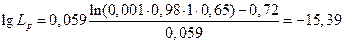 .
.
Откуда Lp = 4,03.10-16.
Растворимость соли AgI определяется концентрацией ионов серебра при растворении данной соли в дистиллированной воде и рассчитывается по соотношению:
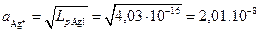 M.
M.
Пример 4.Рассчитать средний коэффициент активности электролита ZnCl2, ели стандартная ЭДС элемента
Znç ZnCl2aqçAgCl,Ag
равна 0,982 В. ЭДС этого элемента при изменении концентрации электролита ZnCl2 изменялась следующим образом:
| c | моль/л | 0,00294 | 0,00781 | 0,0123 | 0,0204 | 0,221 |
| Е | В | 1,198 | 1,165 | 1,149 | 1,131 | 1,055 |
Решение.В рассматриваемом элементе отрицательный электрод (цинковый) обратим относительно катиона, а положительный (хлорсеребрянный) – обратим относительно аниона. ЭДС элемента, составленного из электрода первого рода и электрода второго рода, равна:
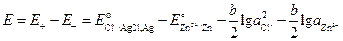 .
.
Используя понятие средней активности ионов электролита, объединим под один логарифм активности ионов ZnCl2:
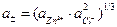 ;
; 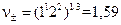 .
.
Откуда:
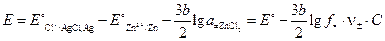 .
.
Значение логарифма среднего коэффициента активности ионов ZnCl2 равно:

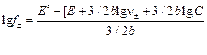 .
.
Значения средних коэффициентов активности ионов ZnCl2 при разных концентрациях электролита равны:
| c | моль/л | 0,00294 | 0,00781 | 0,0123 | 0,0204 | 0,221 |
 f± f±
| 0,770 | 0,695 | 0,630 | 0,61 | 0,41 |
Как видно из полученных данных, с ростом концентрации электролита средний коэффициент активности уменьшается.
Вопросы для самоконтроля
1. Перечислите правила схематической записи электрохимических цепей. Приведите примеры.
2. Что представляет собой стандартный электродный потенциал электрохимического процесса? Как экспериментально можно определить его значение?
3. В чем заключается порядок выполнения работы?
4. Выразите значение произведения растворимости исследуемой соли от потенциала используемой электрохимической цепи и активностей потенциалопределяющих веществ.
5. Как определить произведение растворимости исследуемой соли графическим методом? В каких координатах должна наблюдаться линейная зависимость?
6.Как можно учесть неидеальность раствора при переходе от концентрации иона к его активности. Как определяется ионная сила раствора. Как необходимо изменить координаты графика, чтобы учесть изменение ионной силы растворов?
7. Предложите электрохимический элемент и порядок выполнения работы для определения константы устойчивости комплекса [Ag(S2O3)2]3–.
Дата добавления: 2016-01-09; просмотров: 3448;
