Термодинамика обратимых электрохимических систем
Изменение энергии Гиббса для реакции, обратимо протекающей в гальваническом элементе, можно записать
DrG = – zFЕ. (3.46)
Запишем также уравнение Гиббса — Гельмгольца
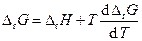 . (3.47)
. (3.47)
Тогда
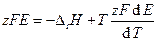 . (3.48)
. (3.48)
Учитывая, что для химической реакции справедливо
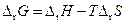 . (3.49)
. (3.49)
Получим
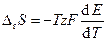 . (3.50)
. (3.50)
Таким образом, температурный коэффициент ЭДС связан с изменением энтропии химической реакции, протекающей в гальваническом элементе.
На практике, измеряя ЭДС гальванического элемента при разных температурах и постоянном давлении, мы можем определить как изменение энтропии, так и изменение энтальпии соответствующей химической реакции.
Потенциометрия
Потенциометрия — метод исследования, в основе которого лежат термодинамические соотношения между ЭДС электрохимических цепей, с одной стороны, и физико-химическими параметрами растворов и химических реакций с другой. Потенциометрию используют для определения
— pH растворов,
— констант гидролиза солей,
— констант диссоциации кислот и оснований,
— произведений растворимости малорастворимых соединений,
— констант устойчивости комплексов,
— коэффициентов активности ионов в растворах,
— термодинамических характеристик химических реакций
— и т. д.
Например, ионное равновесие в растворе характеризуется соответствующими термодинамическими константами. Например, для малорастворимого соединения, диссоциирующего по уравнению
AB 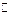 A+ + B–
A+ + B–
равновесие характеризуется произведением растворимости:
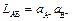 . (3.51)
. (3.51)
Для определения произведения растворимости можно составить гальванический элемент
A | AB | DB || AC | A,
где AC и DB — хорошо растворимые соли соответствующего катиона (A+) и аниона (B–), A+ | A — электрод первого рода, а B– | AB, A — электрод второго рода. На электродах будут протекать следующие реакции:
(1) A+ + e– 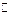 A,
A,
(2) AB + e– 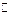 A + B–.
A + B–.
Запишем уравнения Нернста для этих электродов.
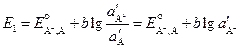 , (3.52)
, (3.52)
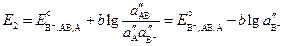 . (3.53)
. (3.53)
Электрод второго рода можно представить как электрод первого рода, только с очень малой концентрацией иона металла, которая будет зависеть от концентрации аниона, образующего с ним малорастворимое соединение. Тогда, учитывая выражение для произведения растворимости, получим
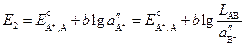 . (3.54)
. (3.54)
Выражение для ЭДС этого элемента будет
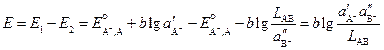 . (3.55)
. (3.55)
Таким образом, произведение растворимости малорастворимого соединения связано с ЭДС рассмотренного элемента, и для его определения необходимо измерить ЭДС элемента при известных активностях иона металла (A+) в растворе первого электрода и аниона B– в растворе второго.
Для определения других термодинамических констант необходимо составлять соответствующие электрохимические цепи и измеряя их ЭДС при известных активностях потенциалопределяющих веществ вычислять значение констант.
Рассмотрим, например, как методом потенциометрии можно оценить термодинамические функции химических реакций  (DG, DA, DS, DH и DU ). Для этого необходимо составить электрохимический элемент, результатом работы которого была бы исследуемая химическая реакция. По ЭДС этого гальванического элемента можно рассчитать:
(DG, DA, DS, DH и DU ). Для этого необходимо составить электрохимический элемент, результатом работы которого была бы исследуемая химическая реакция. По ЭДС этого гальванического элемента можно рассчитать:
1) изменение энергии Гиббса:
DG = - zFE ; (3.56)
2) изменение энергии Гельмгольца:
DA = - zFE - Dn RT, (3.57)
где Dn – изменение числа молей газообразных веществ, участвующих в реакции;
3) изменение энтропии можно оценить, зная зависимость ЭДС элемента от температуры:
DS= zF 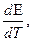 (3.58)
(3.58)
где 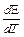 – температурный коэффициент ЭДС. Величину температурного коэффициента ЭДС определяют экспериментально по графической или аналитической зависимости ЭДС элемента от температуры.
– температурный коэффициент ЭДС. Величину температурного коэффициента ЭДС определяют экспериментально по графической или аналитической зависимости ЭДС элемента от температуры.
Например, зависимость ЭДС от температуры можно описать уравнением:
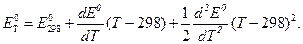 (3.59)
(3.59)
При изменении температуры ЭДС элемента может оставаться постоянной величиной, увеличиваться или уменьшаться в зависимости от величины и знака температурного коэффициента ЭДС.
4) изменение внутренней энергии системы:
DU = Qv = - zF (E-T 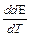 ) - Dn ×RT . (3.60)
) - Dn ×RT . (3.60)
5) тепловой эффект химической реакции:
DH = Qp = - zF(E - T 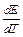 ). (3.61)
). (3.61)
Если реакция в элементе протекает без выделения газов, то можно принять, что
DH = DU , (Qp = Qv) . (3.62)
Приведённые выше выражения можно использовать и для вычисления стандартных величин (DG° , DA°, DS°, DH°, DU°).
Если стандартные термодинамические потенциалы определяются по справочным данным, то возможно решение обратной задачи, то есть определение стандартной ЭДС. При этом используются соотношения:
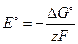 , (3.63)
, (3.63)
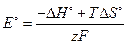 , (3.64)
, (3.64)
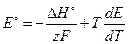 . (3.65)
. (3.65)
Дата добавления: 2016-01-09; просмотров: 2619;
