Кинетика односторонних реакций первого порядка
Для элементарной, необратимой реакции первого порядка
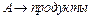
скорость реакции связана со скоростью образования вещества 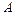 соотношением
соотношением
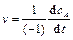 . (4.20)
. (4.20)
На основании постулата формальной кинетики скорость односторонней реакции первого порядка равна:
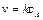 . (4.21)
. (4.21)
Приравнивая эти уравнения и опуская для простоты индекс А, получаем
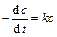 . (4.22)
. (4.22)
Разделив переменные и проинтегрировав левую и правую части полученного уравнения в пределах от 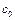 до
до 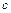 и от 0 до
и от 0 до 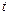 получаем
получаем
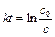 ; (4.23)
; (4.23)
или
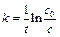 , (4.24)
, (4.24)
где 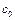 — начальная концентрация исходного вещества;
— начальная концентрация исходного вещества; 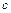 =
= 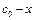 — концентрация исходного вещества к моменту времени t.
— концентрация исходного вещества к моменту времени t.
Потенцируя уравнение (1.12), получим кинетическое уравнение, описывающее зависимость концентрации исходного вещества от времени в явном виде:
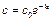 . (4.25)
. (4.25)
Константа скорости реакции первого порядка имеет размерность 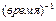 . При этом время реакции может измеряться как в часах, так и в долях секунды, в веках и др. Величина, обратная константе скорости реакции первого порядка, имеет размерность времени и называется средней продолжительностью жизни отдельной частицы.
. При этом время реакции может измеряться как в часах, так и в долях секунды, в веках и др. Величина, обратная константе скорости реакции первого порядка, имеет размерность времени и называется средней продолжительностью жизни отдельной частицы.
При кинетическом исследовании реакций первого порядка вместо концентрации можно использовать любые другие величины, пропорциональные концентрации, т. к. в уравнения (1.12) входит отношение концентраций. Например, концентрации можно заменить количеством исходного вещества 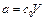 , где V – объем системы. Тогда для константы скорости реакции получаем выражение
, где V – объем системы. Тогда для константы скорости реакции получаем выражение
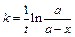 (4.26)
(4.26)
где х – количество прореагировавшего вещества в молях, 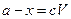 - количество вещества в молях, которое осталось во всем объеме системы к моменту времени t. Из уравнения (1.14) легко получить выражение для зависимости количества прореагировавшего вещества от времени:
- количество вещества в молях, которое осталось во всем объеме системы к моменту времени t. Из уравнения (1.14) легко получить выражение для зависимости количества прореагировавшего вещества от времени:
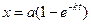 . (4.27)
. (4.27)
Константу скорости можно выразить так же через долю вещества, распавшегося к моменту времени t:
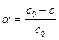 . (4.28)
. (4.28)
Константа скорости в этом случае равна:
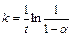 . (4.29)
. (4.29)
В ряде случаев оценить точное значение 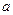 или с0 невозможно. В этих случаях используют выражение:
или с0 невозможно. В этих случаях используют выражение:
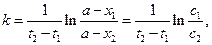 (4.30)
(4.30)
где 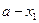 ,
, 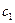 и
и 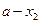 ,
, 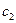 - количества и концентрации исходных веществ для времени t1 и t2 соответственно, причем выбор времени не имеет значения.
- количества и концентрации исходных веществ для времени t1 и t2 соответственно, причем выбор времени не имеет значения.
Для характеристики скорости реакции первого порядка наряду с константой скорости часто пользуются временем полупревращения (период полураспада) – t1/2. Это время, в течение которого прореагирует половина начального количества вещества
(С t = 0,5С0). Из уравнения (4.30) получаем:
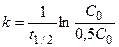 , t1/2 =
, t1/2 = 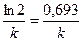 . (4.31)
. (4.31)
Из уравнения (4.31) видно, что период полупревращения для реакций первого порядка не зависит от начальной концентрации исходного вещества.
Уравнения (4.25, 4.27, 4.28) позволяют рассчитать концентрацию исходного вещества и продуктов реакции, скорость реакции в любой момент времени, если известна константа скорости реакции, то есть решить прямую задачу химической кинетики.
Используя уравнения (4.24, 4.26-4.29) можно решить и обратную задачу – выяснить возможность описания зависимости 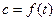 . Зная концентрацию реагента или скорость реакции можно определить константу скорости реакции, являющуюся кинетическим параметром этой зависимости. Для этого, уравнение (4.24) запишем как
. Зная концентрацию реагента или скорость реакции можно определить константу скорости реакции, являющуюся кинетическим параметром этой зависимости. Для этого, уравнение (4.24) запишем как
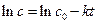 . (4.32)
. (4.32)
Полученное уравнение в координатах 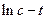 представляет собой уравнение прямой линии. Значения
представляет собой уравнение прямой линии. Значения 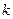 можно найти по тангенсу угла наклона прямой, построенной по опытным данным в координатах
можно найти по тангенсу угла наклона прямой, построенной по опытным данным в координатах 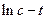 . Значения
. Значения 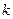 также легко вычислить по уравнению (4.24).
также легко вычислить по уравнению (4.24).
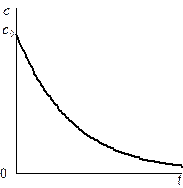

Рис. 4. Рис. 5.
Зависимость концентрации (рис. 4) и логарифма концентрации (рис. 5) исходного
вещества от времени для реакции первого порядка.
Дата добавления: 2016-01-09; просмотров: 2056;
