Примеры решения задач. Пример 1.Константа скорости реакции омыления этилового эфира уксусной кислоты едким натром при 283 К равна 2,38
Пример 1.Константа скорости реакции омыления этилового эфира уксусной кислоты едким натром при 283 К равна 2,38, если концентрацию выражать в кмоль/м3, а время в минутах. Вычислить время, необходимое для омыления 50% этилацетата, если смешать при 283К 1 литр 1/20 М раствора эфира с 1 л 1/20 М щелочи.
Решение. Концентрации эфира и щелочи равны, поэтому для решения следует использовать уравнение (1.19):
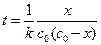 .
.
Так как общий объем смеси равен 2л, то:
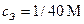 , x = 1/80 М.
, x = 1/80 М.
Концентрация вещества, выраженная в кмоль/м3 и в моль/л имеет одно и то же значение.
Тогда: 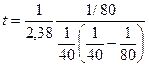 = 16,8 мин.
= 16,8 мин.
Пример 2.Раствор уксусноэтилового эфира при с01 = 0,01М и Т =293 К омыляется 0,002 М (с02) раствором едкого натра за время t1=23 мин. на 10%. В какое время (t2) тот же раствор эфира прореагирует на 10% с раствором щелочи концентрацией 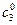 = 0,004 м/л
= 0,004 м/л
Решение. Эта реакция второго порядка, начальные концентрации исходных веществ не равны. Следовательно, для расчета константы скорости реакции воспользуемся уравнением (1.24):
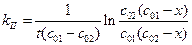 ;
;
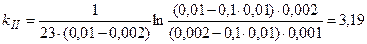 мин.-1×моль-1.
мин.-1×моль-1.
Зная значение константы скорости реакции, находим время t2:

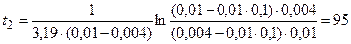 мин.
мин.
Пример 3. Исследование a - радиоактивного изотопа полония показало, что за 14 дней его активность уменьшилась на 6,85 %. Определить период полураспада и рассчитать, в течение какого времени он разлагается на 90 %. То есть в задаче дано:
С0 = 100 %; х = 6,85 %; t = 14 дней.
Решение. Эта реакция относится к реакциям первого порядка.
1) Константу скорости можно рассчитать по уравнению (1.12):
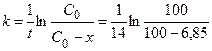 = 5,07×10-3 дней-1.
= 5,07×10-3 дней-1.
2) Период полураспада рассчитаем по уравнению (1.17):
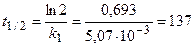 дней.
дней.
3) Рассчитаем промежуток времени, за который изотоп разложится на 90 % :
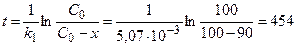 дня.
дня.
Вопросы и задания для самоконтроля.
1. Приведите примеры химических реакций второго порядка. В каком случае их можно считать бимолекулярными?
2. Какой вид примет кинетический закон для реакции второго порядка при условии сА0 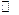 сВ0?
сВ0?
3. Укажите графический способ определения константы скорости для реакции второго порядка, когда сА0 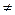 сВ0. В каких координатах кинетическое уравнение имеет вид прямой линии?
сВ0. В каких координатах кинетическое уравнение имеет вид прямой линии?
4. Представьте графически зависимость текущей концентрации реагирующего вещества от времени для реакций различных порядков (сА0=сВ0= сС0: а) 0; б) 1; в) 2; г) 3.
5. Можно ли применять понятие времени полупревращения для реакций второго порядка, когда сА0 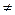 сВ0?
сВ0?
Получите аналитические выражения для времени полупревращения по каждому веществу.
Дата добавления: 2016-01-09; просмотров: 2914;
