Уравнение состояния идеального газа
Уравнением состояния термодинамической системы называется уравнение, которое связывает давление P, объем V и температуру T термодинамической системы, находящейся в состоянии термодинамического равновесия:
 (2.11)
(2.11)
где каждая из переменных является функцией двух других.
Пусть некоторая масса газа занимает объем V1, имеет давление P1 и находится при температуре T1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами V2, P2, T2 (рис.2.3). Переход из состояния 1 в состояние 2 осуществляется последовательно изотермическим (1–1’) и изохорным (1’–2) процессами.
По законам Бойля-Мариотта и Гей-Люссака
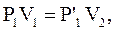
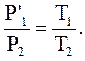
Исключая  , получим уравнение состояния идеального газа:
, получим уравнение состояния идеального газа:
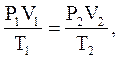
или
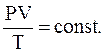 (2.12)
(2.12)
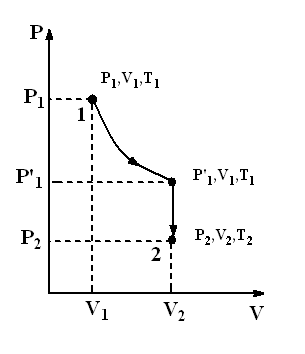
Рис.2.3. Изотермический и изохорный процессы идеального газа
По закону Авогадро при одинаковых P и T моли всех газов занимают одинаковый молярный объем Vm. Уравнение состояния для 1 моля идеального газа:
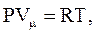
где R = 8,314 Дж/(моль×К) – универсальная газовая постоянная.
Объем газа массы m: 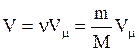 . Отсюда
. Отсюда
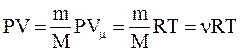 .
.
Уравнение Менделеева-Клайперона – уравнение состояния для массы m идеального газа:
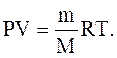 (2.13)
(2.13)
Если использовать постоянную Больцмана: k = R/NA = 1,38×10-23 Дж/К, то уравнение состояния примет вид:
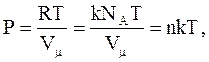 (2.14)
(2.14)
где n = N/V = NA/Vm - концентрация молекул в единице объема.
Таким образом:
1) давление идеального газа при данной температуре прямо пропорционально концентрации его молекул,
2) при одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул.
Дата добавления: 2016-01-07; просмотров: 980;
