Закон Бойля-Мариотта
Для данной массы газа m при постоянной температуре T произведение давления P на объем V есть величина постоянная:
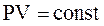 при
при 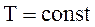 и
и 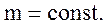 (2.2)
(2.2)
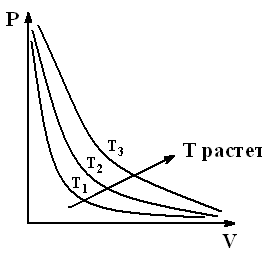 Рис.2.1. Изотермы
Рис.2.1. Изотермы
| Кривая, изображающая зависимость между P и V, характеризующая свойства вещества при постоянной температуре, называется изотермой (рис.2.1). Изотермы – гиперболы, расположенные на графике тем выше, чем выше температура происходящего процесса. |
Закон Авогадро
Количество вещества n - физическая величина, определяемая числом специфических структурных элементов – молекул, атомов или ионов, из которых состоит вещество.
Единица количества вещества – моль – количество вещества системы, содержащее столько же структурных элементов, сколько содержится в 0,012 кг изотопа углерода 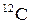 .
.
В одном моле различных веществ содержится одно и то же число молекул NA, называемых числом Авогадро:
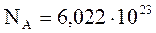
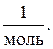
Закон Авогадро: моли любых газов при одинаковой температуре и давлении занимают одинаковые объемы. При нормальных условиях (T = T0, P = P0) этот объем (молярный объем) равен:
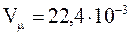
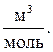
Молярная масса 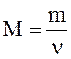 - это масса одного моля вещества, отсюда
- это масса одного моля вещества, отсюда
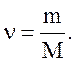 (2.3)
(2.3)
Единица молярной массы – килограмм на моль (кг/моль).
Закон Дальтона
Парциальным называется давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений P1, P2,..., Pn входящих в неё газов:
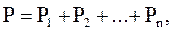
или
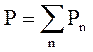 . (2.4)
. (2.4)
Дата добавления: 2016-01-07; просмотров: 778;
