Термодинамическая система
Термодинамической системой называют совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой).
Термодинамические системы, не обменивающиеся с внешней средой ни энергией, ни веществом, называются замкнутыми.
Основа термодинамического метода – определение состояния термодинамической системы.
Состояние системы задается термодинамическими параметрами (параметрами состояния) – совокупностью физических величин, характеризующих свойства термодинамической системы (объем, давление, температура).
Параметры состояния могут изменяться. Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из её термодинамических параметров, называется термодинамическим процессом. Если для данной системы внешние условия не изменяются и состояние системы с течением времени не меняется, то эта система находится в термодинамическом равновесии.
Температура
Температура – одно из основных понятий, играющих важнейшую роль в физике в целом.
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы и определяющая направление теплообмена между телами.
В настоящее время используют две температурные шкалы.
Международная практическая шкала (шкала Цельсия) градуирована в градусах Цельсия (°С) по двум реперным точкам – температурам замерзания и кипения воды при давлении 1,013×105 Па, которые принимаются соответственно 0°С и 100°С.
Термодинамическая температурная шкала (шкала Кельвина), градуированная в градусах Кельвина (К), определяется по одной реперной точке – тройной точке воды – температуре, при которой лед, вода и насыщенный пар при давлении 609 Па находятся в термодинамическом равновесии. Температура этой точки по данной шкале равна 273,15 К. Температура T=0 К называется нулем Кельвина.
Термодинамическая температура (T) и температура (t) по международной практической шкале связаны соотношением
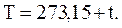 (2.1)
(2.1)
Нормальные условия: T0 = 273,15 К = 0°С; P0 = 101325 Па.
Идеальный газ
Идеальным газом называется физическая модель, согласно которой:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Исходя из этого, идеальный газ можно рассматривать как совокупность беспорядочно двигающихся шариков-молекул, имеющих пренебрежимо малый собственный объем и не взаимодействующих друг с другом на расстоянии.
Законы, описывающие поведение идеальных газов, – законы Бойля-Мариотта, Шарля, Авогадро, Дальтона, Гей-Люссака.
Дата добавления: 2016-01-07; просмотров: 950;
