Представление о структуре белка
Белки — это природные полимеры, состоящие из большого числа аминокислотных звеньев, имеющие сложное строение. Молекулярная масса белков может колебаться от 10 тысяч до нескольких миллионов.
Белки весьма разнообразны по своей природе и строению. Белки, состоящие только из a-аминокислот, называют простыми белками. Такие белки подразделяют по растворимости в воде на глобулярные и фибриллярные.
Глобулярные белки — это простые белки, растворимые в воде или образующие в ней коллоидные растворы. Все глобулярное белки растворимы в разбавленных водных растворах кислот, оснований, солей. В концентрированных же растворах кислот, солей, органических растворителях (любой концентрации) глобулярные белки осаждаются. Глобулярные белки, например, альбумин (яичный белок) и казеин (составная часть молока) имеют трехмерную структуру. Действие концентрированных кислот и щелочей, повышение температуры и т.п. приводит к нарушению трехмерной структуры. В этом случае говорят о денатурации белка. Итак, глобулярные белки хорошо растворимы в воде и легко денатурируются.
Фибриллярные белки — простые белки, нерастворимые в воде, имеют молекулы линейного строения, устойчивы к действию кислот и щелочей. Примерами фибриллярных белков являются кератин (из него состоят ногти, волосы, перья, роговые ткани), коллаген (мускулы, сухожилия), эластин (кровеносные сосуды, сухожилия), фиброин (шелк).
Структура белка
В белках различают первичную, вторичную, третичную и четвертичную структуры.
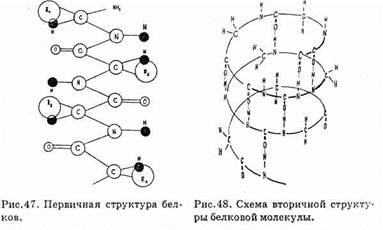
Первичная структура белка определяется последовательностью ковалентно связанных аминокислотных остатков в полипептидной цепи (рис. 47). Практически все белки построены из 20 аминокислот. Аминокислотный состав белка устанавливают, подвергая белок полному гидролизу. Для этого белок обычно нагревают в растворе соляной кислоты. Образующиеся аминокислоты количественно определяют.
Чаще всего первичную структуру записывают следующим образом: гли-изол-вал-глут..., используя сокращенные названия аминокислот. Каждый индивидуальный белок имеет характерную только для него первичную структуру.
Вторичная структура белка, характеризующая тип укладки полипептидных цепей, — это упорядоченное свертывание полипептидной цепи в результате образования внутримолекулярных водородных связей между карбоксо- и аминогруппами. Образование внутримолекулярных водородных связей в глобулярных белках может приводить к возникновению спиральной структуры, называемой a-спиралью. В фибриллярных белках образование водородных связей может привести к возникновению складчатой листовой структуры (см. рис. 48).
Под третичной структурой белка понимают расположение его полипептидной цепи в пространстве. В молекулах белка происходит свертывание полипептидной цепи, приводящее к нало-
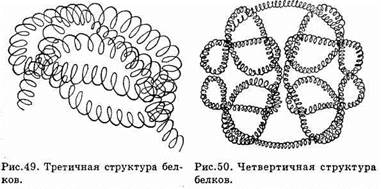
жению одних участков a-спирали и складчатого листа на другие участки цепи. Таким образом происходит «сшивание» различных участков полипептидной цепи. Это «сшивание» происходит в результате образования химических связей и различных взаимодействий между боковыми цепями аминокислотных остатков. Третичная структура белка обуславливает специфическую биологическую активность белковых молекул.
Третичная структура белка поддерживается за счет взаимодействия различных функциональных групп полипептидной цепи (как было сказано выше). Наиболее распространенной формой «сшивания» между цепями является образование дисульфидных мостиков (связей) между атомами серы двух цистеиновых остатков (—S—S—). Кроме того, следует отметить:
— сложноэфирный мостик между карбоксильной и гидроксильной группами (—СО—ОН—);
— солевой мостик между карбоксильной группой и аминогруппой (-CO-NH2-) (см. рис. 49).
Четвертичная структура белка (рис. 50). Огромные белковые субъединицы, обладающие определенной третичной структурой, могут объединяться в еще более крупный агрегат — так образуется четвертичная структура. Каждая субъединица имеет отдельную полипептидную цепь. В некоторых белках такие субъединицы одинаковы или имеют сходное строение, а другие белки состоят из субъединиц с цепями различных типов. Четвертичная структура удерживается как единое целое благодаря взаимодействиям между боковыми цепями, как и в третичной структуре. Так как в состав четвертичной структуры входит и третичная структура белка, следовательно, четвертичная структура белка (как и третичная) определяет его специфическую активность.
Пример белка с четвертичной структурой —гемоглобин. Этот тип надмолекулярной организации имеется не у всех белков.
Какова же роль столь сложных молекул в процессе жизнедеятельности? Важнейшая роль белков заключается в их способности катализировать отдельные биохимические реакции. Такие катализаторы получили название ферментов. Сложность строения белка обеспечивает возможность «распознавания» ими молекул, необходимых для данной химической реакции, среди огромного количества молекул, находящихся в живом организме.
Расшифровка первичной, вторичной, третичной и четвертичной структуры белков — грандиозный успех науки. Чтобы достичь его, потребовались десятки лет труда многих выдающихся ученых. Сейчас мы знаем даже механизм каталитического действия некоторых ферментов. Осуществлен лабораторный синтез простейших белков. С помощью генной инженерии удается уже сегодня заставить бактерию производить необходимый человеку белок, например инсулин (он нужен для лечения больных диабетом). Но все это только начало. Биоорганическая химия лишь начинает по-настоящему глубоко постигать тайны происходящих в живом организме химических процессов.
Дата добавления: 2016-01-03; просмотров: 1377;
