Галогенкарбоновые кислоты.
Атомы водорода в радикале кислот способны замещаться на галоген с образованием галогенкарбоновых кислот. Примерами галогенкарбоновых кислот могут служить моно-, ди- и трихлоруксусная кислоты: СН2СlСООН, СНСl2СООН и ССl3СООН. Они являются продуктами хлорирования кислоты.
Различают кислоты с атомами галогена в a-, b-, g, d- и других положениях цепи, например:
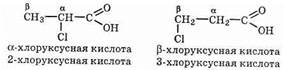
Рассмотрим галогенирование уксусной кислоты.
При пропускании хлора в кипящую уксусную кислоту в присутствии красного фосфора образуется хлоруксусная кислота — кристаллическое вещество с tплавл=61°С:
СН3СООН(ж)+Сl2(г)®Р(ирасный), кипячение СlСН2СООН(тв)+НСl(г)
Если продолжать пропускание хлора и повышать температуру, происходит дальнейшее замещение, приводящее к образованию дихлоруксусной и трихлоруксусной кислот:
СlСН2СООН®Cl2 Сl2НСООН®Cl2 С13ССООН
Гомологи уксусной кислоты галогенизируются только в a-положение. Катализатором могут служить также галогениды фосфора (III):
СН3СН2СООН®Br2 PBr3 CH3CHBrCOOH®Br2 PBr3СН3СВг2СООН
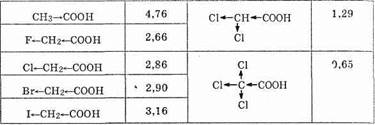
Галогенкарбоновые кислоты — более сильные, чем кислоты, не содержащие галогена.
Это видно из приведенных ниже значений рKа:
Вспомним, что силу кислоты НХ в воде, т.е. степень ее диссоциации, можно определить, рассматривая равновесие:
Н2O:+НХ«Н3О++X-
Константа такого равновесия выражается уравнением:
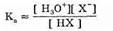
где концентрация воды является величиной постоянной, поскольку вода присутствует в избытке. Следует иметь в виду, что Кл — константа кислотности данной кислоты в воде — только приблизительно выражается таким уравнением, поскольку в нем вместо активностей используются концентрации. На величину константы кислотности влияют состав раствора, в котором находится кислота (см. ниже), а также другие факторы, но тем не менее эта величина достаточно полно характеризует силу кислоты.
Для того чтобы избежать написания отрицательных степеней, вместо величины Ка обычно пользуются величиной pKа:
pKa=-lgKa
Так, например, если для уксусной кислоты в воде величина Кa составляет 1,79•10-5, то значение рКa равно 4,76. Чем меньше рКа, тем сильнее соответствующая кислота.
Сила фторуксусной кислоты почти в сто раз выше, чем самой уксусной кислоты. Дальнейшее введение в молекулу кислоты атомов галогена еще более усиливает кислотность: трихлоруксусная кислота представляет собой уже очень сильную кислоту (см. выше).
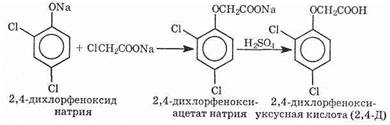
Галогенкарбоновые кислоты нашли широкое применение в органическом синтезе. Например, хлоруксусная кислота — исходное вещество в синтезе пестицида — 2,4-дихлорфеноксиуксус-ной кислоты (техническое название — 2,4-Д):
Дата добавления: 2016-01-03; просмотров: 3986;
