Орто-, мета- и дифосфорные кислоты. Ортофосфаты
Оксид фосфора (V) Р2О5, взаимодействуя с водой, образует метафосфорную кислоту НРО3; последняя при кипячении образует
Таблица 23. Фосфорные кислоты
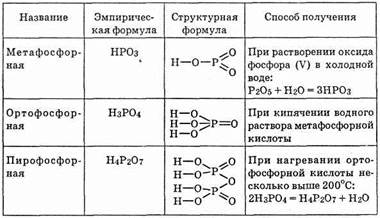
ортофосфорную кислоту Н3РО4; при нагревании Н3РO4 образуется дифосфорная (или пирофосфорная) кислота Н4Р2О7 (см. табл. 23).
Метафосфорная кислота неустойчива и в чистом виде не выделена, так же как не выделены из растворов ее соли. Может существовать в виде полимеров (НРО3)n. Причем возможны макромолекулы, начиная со степени полимеризации л = 3. Метафосфорная кислота очень сильная, все ионы водорода в ней диссоциированы. Однако им не свойственны ни окислительные, ни восстановительные качества. Водой макромолекулы метафосфорной кислоты расщепляются до Н3РО4.
Таким образом, метафосфорные кислоты неустойчивы и представляют собой лишь промежуточную ступень реакции гидратации оксида фосфора (V) Р2О5.
Ортофосфорная кислота Н3РO4 — наиболее устойчивая из всех кислот пятивалентного фосфора. Представляет собой твердое бесцветное кристаллическое легкоплавкое вещество. Ее кристаллы на воздухе превращаются в сиропообразную массу. Не ядовита. С водой смешивается в любых соотношениях. При нормальной температуре инертна, не восстанавливается углем и даже водородом. Не проявляет ни окислительных, ни восстановительных свойств. Но при нагревании взаимодействует с металлами и их оксидами, действует на кварц и даже золото.
Как кислота она обладает средней силой. Проявляет свои кислотные свойства при взаимодействии с щелочами:
NaOH+H3PO4=NaH2PO4+H2O
В промышленности ортофосфорную кислоту получают двумя способами: экстракционным и термическим. По первому способу измельченный фосфат кальция обрабатывают серной кислотой:
Са3(РO4)2+3H2SO4=2Н3РО4+3CaSO4¯
CaSO4 выпадает в виде осадка, а кислота остается в растворе. При этом в раствор кислоты переходят многие примеси — сульфаты железа, алюминия. Такая кислота идет на производство удобрений.
По второму способу сначала получают фосфор (восстановлением природных фосфатов). Затем он окисляется до Р4О10, а последний взаимодействует с водой. Получается чистая кислота (концентрация до 80%).
В молекуле ортофосфорной кислоты атомы водорода соединены с атомами кислорода:
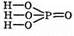
В водном растворе ортофосфорная кислота подвергается ступенчато диссоциации:
I ступень: Н3РO4«Н++Н2РO-4
II ступень: Н2РO-4«Н++НРО2-4
III ступень: НРO2-4«Н++РO3-4
Обычно преобладает I ступень диссоциации. Будучи трехосновной, она образует соли — ортофосфаты трех видов:
1) фосфаты — замещены все атомы водорода в фосфорной кислоте (К3РO4, (NH4)3PO4);
2) гидрофосфаты — замещены два атома водорода кислоты (К2НРO4, (NH4)2HPO4);
3) дигидрофосфаты — замещен один атом водорода кислоты (КН2РO4, NH4H2PO4).
Все фосфаты щелочных металлов и аммония растворимы в воде. Из кальциевых солей фосфорной кислоты растворяется в воде лишь Са(Н2РО4)2 — дигидрофосфат. Гидрофосфат кальция СаНРО4 и фосфат кальция Са3(РO4)2 растворимы в органических кислотах.
Соли ортофосфорной кислоты представляют собой ценные минеральные удобрения.
Суперфосфат — смесь CaSO4 и Са(Н2РО4)2•Н2О. Для получения суперфосфата природный фосфорит обрабатывают серной кислотой:
Са3(РO4)2+2H2SO4=2CaSO4+Сa(Н2РO4)2
Двойной суперфосфат Са(Н2РО4)2 получают действием фосфорной кислоты на природный фосфат кальция:
Са3(РO4)2+4Н3РO4=3Са(Н2РO4)2
Преципитат СаНРО4•2Н2О нерастворим в воде, но растворяется в кислых почвах. Чистый преципитат употребляют в качестве фосфорноизвестковой добавки к корму скота. Получают из гидроксида кальция:
Са(ОН)2+Н3РO4=СаНРO4•2Н2O
Аммофос — смесь NH4H2PO4 и (NH4)2HPO4 — ценное удобрение, содержащее азот и фосфор. Получают взаимодействием аммиака с фосфорной кислотой.
Дигидрофосфат натрия NaH2PO4 применяют в медицине.
Дифосфорная кислота Н4Р2О7 представляет собой мягкую стекловидную массу (tпл=61°С), легкорастворимую в воде. Кислота четырехосновная и является более сильной, чем ортофосфорная.
Дата добавления: 2016-01-03; просмотров: 9959;
