Физические свойства. Фосфор может существовать во многих модификациях
Фосфор может существовать во многих модификациях. В настоящее время насчитывается до 11 аллотропных форм. «Многоликость» фосфора можно, однако, свести к трем главным видам: белому, красному и черному.
Наиболее распространенной модификацией является белый фосфор — воскообразное бесцветное и очень ядовитое вещество с tплав= 44,1°С и tкип=280°С. В воде он практически нерастворим, но с водяным паром он довольно легко дает газовую смесь. Хорошо растворим в эфире, бензоле, скипидаре и жирных маслах, но лучше всего в сероуглероде. Воспламеняется при трении, поэтому его режут на куски только под водой. В темноте светится. При длительном г нагревании (250°С) белый фосфор переходит в красный.
Красный фосфор — порошок красно-бурого цвета, абсолютно безвреден. Менее активен, чем белый фосфор, нерастворим в воде и сероуглероде, не светится в темноте. Представляет собой смесь нескольких аллотропных модификаций, которые отличаются друг от друга цветом (от алого до фиолетового) и некоторыми другими свойствами.
Черный фосфор — самая устойчивая форма этого элемента. По внешним признакам он напоминает металл: обладает окраской цвета железа, имеет металлический блеск, обладает металлической электропроводностью, твердостью и теплопроводностью. Наименее активный из твердых форм элементарного фосфора. Его
можно распилить на воздухе, а если поджечь спичкой, то черный фосфор загорается с трудом.
Получается длительным нагреванием белого фосфора при 200°С и давлении 1200 МПа.
Свойства аллотропных модификаций фосфора объясняются их строением. Более подробно изучено строение белого фосфора. Он имеет молекулярную кристаллическую решетку. Его молекулы четырехатомны (P4 — тетрафосфор) и имеют форму правильной трехгранной пирамиды.
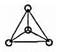
Каждый атом фосфора находится в одной из вершин пирамиды и связан тремя pi-связями с другими тремя атомами. Красный и черный фосфор имеют многоатомную кристаллическую решетку.
Химические свойства
В жидком и растворенном состоянии, а также в парах при температуре ниже 800°С фосфор состоит из молекул P4. При нагревании выше 800°С молекулы диссоциируют: Р4«2Р2. Последние при температуре выше 2000°С распадаются на атомы: Р2«2Р
Атомы фосфора могут объединяться в молекулы Р2, Р4 и в полимерные вещества.
Химическая активность фосфора значительно выше, чем азота.
Фосфор легко окисляется кислородом: в избытке кислорода образуется оксид фосфора (V), а при недостатке — оксид фосфора (III):
4Р+5O2=2Р2O5
4Р+3О2=2Р2О3
При окислении на воздухе реакция сопровождается свечением, т.е. имеет место хемилюминесценция (выделение света при химических реакциях).
Фосфор взаимодействует со многими простыми веществами — галогенами, серой и некоторыми металлами, проявляя и окислительные, и восстановительные свойства. Соединения фосфора с металлами называют фосфидами.
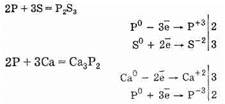
2Р+3Сl2=РСl3 РСl3+Сl2=РСl5
Фосфор дает соединения и с элементами побочной подгруппы своей же V группы: VP, VP2, NbP, NbP2, TaP, TaP2.
Сильные окислители превращают фосфор в фосфорную кислоту:
3P+5HNO3+2Н2О= 3Н3PO4+5NO
Реакции с белым фосфором идут легче, чем с красным.
Фосфор в обычных условиях не взаимодействует с водородом, поэтому соединение фосфора с водородом — фосфин — получают либо реакцией фосфора с щелочами:
Р4+3KОН+3Н2О=РН3+3KН2РO2 либо взаимодействием фосфидов с водой:
Са3Р2+6Н2О= ЗСа(ОН)2+2PH3
Фосфин РН3 — бесцветный газ с запахом «гнилой рыбы». Очень ядовит, на воздухе воспламеняется, а при некоторых условиях может образовывать взрывчатые смеси. Фосфин при обычных температурах не разлагается, но при повышенных температурах и в отсутствие кислорода распад происходит в заметной степени:
4РН3«Р4+6Н2
Плохо растворим в воде: 1 объем фосфина растворяется в 4 объемах воды. Известен очень нестойкий кристаллогидрат фосфина РН3•Н2О, соответствующий составу гидроксида РН4ОН, однако свойства основания у этого соединения отсутствуют.
Соли фосфина, схожие по структуре с солями аммония, образуются при взаимодействии растворов сильных бескислородных кислот с газообразным фосфористым водородом. По сравнению с солями аммония они менее устойчивы.
РН4Сl, РН4Br, РН4I
Перхлорат фосфония РН4СlО4 взрывчат, а галогениды при нагревании полностью распадаются: РН4Сl=РН3+НСl
При определенных соотношениях кислорода и РН3 смесь самовоспламеняется:
2РН3+4O2 = P2O5+3Н2O
Фосфин — один из сильнейших восстановителей. Он восстанавливает соли металлов в растворах до фосфидов и в некоторых случаях до металлов:
3CuSO4+2PH3=Cu3P2+3H2SO4
С галогенидами фосфора фосфин реагирует до выделения свободного фосфора:
ЗРСl3+РН3=4РС13+ЗНСl и далее:
2РСl3+2РН3=Р4+6НСl
Применение
Красный фосфор используют в спичечной промышленности. Из красного фосфора, сульфида сурьмы (III), железного сурика (природного оксида железа (III) с примесью кварца) и клея приготавливают смесь, которую наносят на боковые поверхности спичечной коробки. Головка спичек состоит главным образом из хлората калия, молотого стекла и клея. При трении головки о намазку спичечной коробки красный фосфор воспламеняется, поджигает состав головки, а от него загорается дерево.
Белый фосфор широкого применения не имеет. Обычно его используют для образования дымовых завес. Черный фосфор применяют очень редко.
Дата добавления: 2016-01-03; просмотров: 2135;
