Кислоты, гидроксиды, соли и комплексные соединения. 2 страница
Препаративный метод синтеза манганита состоит в окислении сульфата марганца 3 %-ным раствором пероксида водорода в аммиачной среде:
2MnSO4 + H2O2 + 4NH3 + 2H2O = 2MnOOH¯ + 2(NH4)2SO4
В этой реакции окислителем выступает также кислород, образующийся при каталитическом разложении пероксида на частицах продукта. Осадок, отфильтрованный и высушенный при 100 °C, имеет состав MnOOH.
Оксогидроксид марганца(III) является амфотерным основанием. При кипячении его со щелочами образуются красные растворы, из которых кристаллизуются гидроксоманганаты(III), например, Na3[Mn(OH)6].2,5H2O и Na4[Mn(OH)7].5H2O, Ba2[Mn(OH)7] и Ba[Mn(OH)5]. В твердой фазе получены соединения состава NaMnO2, Na4Mn2O5, Ca2Mn2O5, Ca4Mn2O7 (K.R. Poepplmeier, M.E. Leonowicz, J.M. Longo, J. Solid State Chem., 1982, 44, 89).
При растворении MnOOH на холоду в крепкой серной кислоте образуется красный раствор, из которого могут быть выделены красные кристаллы кислого сульфата Mn2(SO4)3×H2SO4×8H2O, на самом деле представляющие собой анионный комплекс H5O2+[Mn(SO4)2(H2O)2]– (F.M. Cgang, M. Jansen, D. Schmitz, Acta Cryst. C, 1983, 39, 1497). Перекристаллизация из концентрированной серной кислоты, действующей в качестве водоотнимающего средства, приводит к гигроскопичным темно-зеленым игольчатым кристаллам среднего сульфата Mn2(SO4)3 неизвестного строения. Он представляет собой ковалентное соединение, растворимое в серной кислоте, но гидролизующееся при разбавлении этого раствора водой (J.B. Vincent, H.R. Chang, K. Falting, J.C. Huffman, G. Christou, D.N. Hendrickson, J. Amer. Chem. Soc., 1987, 109, 5703). При контролируемом гидролизе может быть получен основный сульфат Mn(OH)SO4(H2O)2 (K. Mereiter, Acta Cryst. B., 1979, 35, 579).
Наиболее распространенным методом получения солей марганца(III) служат окислительно-восстановительные превращения. Так, сульфат марганца(III) может быть получен также анодным окислением горячего раствора сульфата марганца(II) в серной кислоте:
эл. ток
2MnSO4 + H2SO4 ¾¾¾® Mn2(SO4)3 + H2
или восстановлением перманаганата калия серной кислотой:
2KMnO4 + 4H2SO4 = Mn2(SO4)3 + K2SO4 + 2O2 + 4H2O.
Если тонкий порошок KMnO4 обработать ледяной уксусной кислотой, постепенно происходит его восстановление, ускоряющееся при нагревании. Около температуры кипения интенсивно выделяется СО2. Если образовавшийся красно-коричневый раствор смешать с концентрированной серной кислотой до растворения осадка и прокипятить, то при охлаждении из него выпадают красные кристаллы квасцов,
2KMnO4 + CH3COOH + 4H2SO4 + 6H2O = 2KMn(SO4)2×12H2O ↓ + 2CO2↑,
В присутствии воды они нацело гидролизуются, превращаясь в оксогидроксид марганца(III), а при температуре выше 0 °C разрушаются. Устойчивость квасцов возрастает с увеличением размера катиона щелочного металла, но даже цезиевые квасцы разлагаются при температуре чуть выше комнатной.
Нитрат марганца(III) в чистом виде не описан, однако известны его аддукты с азотдонорными лигандами, например, Mn(NO3)3phen и анионный нитрониевый комплекс NO2+[Mn(NO3)4]–. Синтезировано большое количество фосфатов марганца(III), например, серо-зеленый MnPO4×H2O, красно-фиолетовый Mn(PO3)3 (M. Bagieu-Beucher, Acta Cryst. B., 1978, 34, 1443), красный, растворимый в воде NaMn(HPO4)2 и разнообразные фиолетовые пирофосфаты, образующиеся в окислительном пламени при получении фосфатных перлов с солями марганца(II):
2NaNH4HPO4 + Mn(NO3)2 = NaMnP2O7 + 2NH3 + NaNO3 + NO2 + 2H2O.
Ранее они использовались в качестве пигментов. Доказано, что при действии окислителей (KMnO4, HNO3) на раствор соли марганца(II) в присутствии избытка пирофосфат-ионов образуются фиолетовые растворы, в которых в умеренно кислой среде доминирует комплекс [Mn(H2P2O7)3]3–.
Оксалат марганца(III) существует только в форме комплексных соединений. Исходный комплекс готовят in situ , восстанавливая перманаганат избытком щавелевой кислоты и добавляя поташ как дополнительный источник ионов K+:
2KMnO4 + 11H2C2O4 + 3K2CO3 = 2K4[Mn(C2O4)3] + 13CO2 + 11H2O,
4K4[Mn(C2O4)3] + KMnO4 + 4H2C2O4 = 5K3[Mn(C2O4)3] + 4H2O + K2C2O4
Другим методом синтеза является растворение оксогидроксида марганца(III) в растворе, cодержащем щавелевую кислоту и оксалат калия (Bhattacharjee M.N., Chaudhuri M.K., Dutta Purkayastha R.N. Inorg. Chem., 1985, 24, 447):
2MnOOH + 3H2C2O4 + 3K2C2O4 = 2K3[Mn(C2O4)3] +4H2O.
Образующиеся при охлаждении красно-фиолетовые кристаллы настолько чувствительны к свету, что все работы с ними, включая синтез, следует проводить в темноте. На свету происходит внтуримолекулярная окислительно-восстановительная реакция:
2K3[Mn(C2O4)3] = 2MnC2O4 + 3K2C2O4 + 2CO2
Водные растворы комплекса даже в отсутствие света становятся желтыми вследствие реакции замещения:
K3[Mn(C2O4)3] + 2H2O  K[Mn(C2O4)2(H2O)2] + K2C2O4
K[Mn(C2O4)2(H2O)2] + K2C2O4
Ион [Mn(C2O4)2(H2O)2]– существует в виде двух изомеров – зеленого (цис-) и желтого (транс-) (W. Levason, C.A. McAuliffe, Coord. Chem. Rev., 1972, 7, 353).
Ацетилацетонат марганца(III) Mn(acac)3 получают взаимодействием ацетилацетона с крепким водным раствором перманганата калия. Комплекс, выделяющийся в виде коричневого осадка, очищают сублимацией. Он состоит из октаэдрических молекул.
Гексацианоманганат(III) калия получают окислением гексацианоманганата(II) перманаганатом калия. Темно-красный гексацианоманганат(III) K3[Mn(CN)6], образующийся при продувании воздуха через водный раствор соли марганца(II), в который добавлен избыток цианистого калия, или при растворении карбоната марганца в водном растворе цианида под действием пероксида водорода
2MnCO3 + 12KCN + H2O2 = 2K3[Mn(CN)6] + 2K2CO3 + 2KOH,
является редким примером низкоспинового комплекса марганца(III). Интересно, что в отличие от большинства других гексацианометаллатов, он лабилен и поэтому легко разлагается водой до MnOOH. При действии на гексацианокомплекс раствором хлорной кислоты выделяется осадок Mn(CN)3, который, как показано (B. Ziegler, M. Witzel, M. Schwarten, D. Babel, Z. Naturforschung, Teil. B., 1999, 54, 870), представляет собой гексацианоманаганат(IV) марганца(II) MnII[MnIV(CN)6] (Рис.5.24. Строение MnII[MnIV(CN)6]). Это является еще одним доказательством неустойчивости соединений марганца(III) к диспропорционированию.
Для марганца(III) известны также и многоядерные комплексы, в которых роль мостиковых лигандов выполняют атомы кислорода. К простейшим примерам относится желто-коричневый диядерный цианокомплекс K7[Mn2O(CN)10], образующийся в качестве побочного продукта при получении гексацианоманаганата(III).
Основный ацетат марганца(III), долгое время считавшийся “дигидратом Mn(CH3COO)3×2H2O”, на самом деле представляет собой трехъядерный оксокомплекс [Mn3O(CH3COO)6(H2O)6]+CH3COO– (C.L. Raston, A.H. White, A.C. Willis, K.S. Murray, Journ. Chem. Soc., Dalton Trans., 1974, 1793), построенный аналогично другим оксоацетатам трехвалентных металлов (алюминия, см. том 2, с. 100, ванадия, см. том 3, с., хрома, см. том 3, стр.) Коричневые, с шелковистым блеском кристаллы этой соли получают окислением ацетата марганца(II) в ледяной уксусной кислоте перманганатом:
3KMnO4 + 12Mn(CH3COO)2 + 14CH3COOH + 23H2O = 5Mn3O(CH3COO)7(H2O)6 + 3CH3COOK.
Безводная соль, образующаяся в виде коричневого порошка при взаимодействии нитрата марганца(II) с уксусным ангидридом
6Mn(NO3)2 + 8(CH3CO)2O + H2O = 2Mn3O(CH3COO)7 + 12NO2 + 3/2O2 + 2CH3COOH,
по-видимому, также содержит в своем составе трехъядерные фрагменты [Mn3O(CH3COO)6(H2O)6]+, связанные друг с другом ацеататными мостиками. Оба вещества устойчивы при хранении в отсутствии влаги, но в воде необратимо гидролизуются. Их часто используют в лабораторной практике для синтеза других соединений марганца(III) по реакциям обмена.
Еще более сложное строение имеют карбоксилатные комплексы марганца со смешанными степенями окисления. Соединение Mn12O12(CH3COO)16(H2O)4 , впервые полученное в виде темно-красных кристаллов в виде примеси к «дигидрату», образующейся при использовании избытка перманганата калия (P.D.W. Boyd, Q. Li, J.B. Vincent et al, Journ. Amer. Chem. Soc., 1988, 110, 8537; V. McKee, Adv. Inorg. Chem., 1994, 40, 323; G. Christou et al, Inorg. Chem., 1991, 30, 1665; G. Christou et al, Journ. Amer. Chem. Soc., 1993, 115, 1804), можно представить как центральный куб Mn4IVO4, построенный из четырех атомов марганца(IV) и четырех атомов кислорода, к которому присоединены 16 μ2-мостиковых ацетатных групп и 12 μ3-мостиковых атомов кислорода. Из двенадцати атомов марганца четыре центральных имеют степень окисления +4, а восемь остальных +3. (Рис.5.25. Строение Mn12O12(CH3COO)16(H2O)4). Часть ионов Mn3+ в структуре комплекса может быть замещена на ионы Fe3+ до состава [Mn8Fe4O12(CH3COO)16(H2O)4]. Благодаря обменному взаимодействию между атомами металла, входящими в состав молекулы, их магнитные моменты суммируются и действуют как единый «суперспин». Такого рода соединения представляют собой перспективные молекулярные магнитные материалы (Sessoli R., Gatteschi D., Caneschi A., Novak M.A., Nature, 1993, 365, 141).
Все соединения марганца(III), особенно образованные лигандами слабого поля и хорошо растворимые в воде, являются сильными окислителями. Они выделяют иод из иодида калия, окисляют сероводород до серы:
Mn2(SO4)3 + 2KI = 2MnSO4 + I2+ K2SO4
Только сильные окислители в щелочной среде переводят их в манганаты(VI).
Химия технеция и рения в низших степенях окисления сильно отличается от химии соединений марганца наличием большого числа соединений со связью металл-металл и практически полным отсутствием простых катионных форм. Гидратированные оксиды, по составу приближающиеся к дигидратам, получают гидролизом галогенидов в отсутствии кислорода воздуха. Гидратированный оксид рения(III) постепенно разлагает воду с выделением водорода, а при попытке обезвоживания диспропорционирует.
Химия технеция(III) и рения(III) представлена в основном галогенидами и комплексными соединениями. Подобно марганцу, эти металлы образуют октаэдрические комплексы. Обычно их получают восстановлением пертехнетатов и перренатов. Наиболее устойчивы комплексы с π-акцепторными лигандами, например, фосфинами.
Исходным веществом для синтеза разнообразных комплексных соединений рения служит аддукт оксохлорида с трифенилфосфином, образующийся в виде желтых призматических кристаллов при кипячении рениевого ангидрида или перрената калия с соляной кислотой и трифенилфосфином в водно-спиртовом растворе:
2KReO4 + 8HCl + 6PPh3 = 2ReOCl3(PPh3)2 + 2PPh3O + 2KCl + 4H2O.
При взаимодействии его с первичными аминами образуются иминокомплексы, с фенилгидразоном – хелат, а с уксусным ангидридом – диядерный ацетат, построенный аналогично ацетату хрома(II) Cr2(CH3COO)4(H2O)2, но содержащий вместо воды координированные атомы хлора:
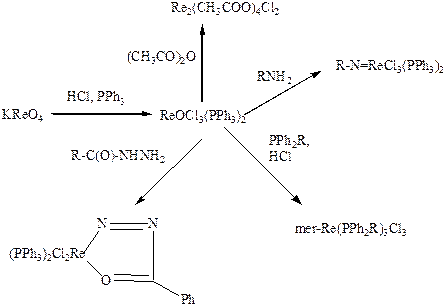
Аналогичное строение имеет диядерный анион, обнаруженный в двойном сульфате рения(III)-аммония (NH4)2Re2(SO4)4(H2O)2 (Рис. 5.26. Строение [Re2(SO4)4(H2O)2]2–) (Козьмин П.А., Ларина Т.Б., Суражская М.Д., Котельникова А.С., Османов Н.С., Коорд. хим., 1980, 6, 1264). Эта соль образуется при растворении димерного трихлоромоноформиаторената(III) аммония в H2SO4. Димерные анионы содержат четверную связь Re-Re (0,2217 нм)и соединены мостиковыми сульфатными группами (Re-O 0,202 нм).
Некоторые комплексы способны сохранять состав и строение координационной сферы при окислительно-восстановительных превращениях. Это используют в синтезе. Например, роданотехнетаты(III) [Tc(NCS)6]3- получают восстановлением [Tc(NCS)6]2- гидразином.
Кроме октаэдрических, известны комплексы с другими координациями центрального атома: например, 7-координированный [M(CN)7]4-
Многие комплексы Тс(III) и Re(III) легко окисляются до высших степеней окисления. Кластеры, подобные описанному выше ацетату рения(III), обладают повышенной устойчивостью, благодаря кратной связи металл-металл.
Степень окисления +4 (d3).
Данная степень окисления для марганца представлена сравнительно небольшим числом соединений, премущественно комплексных. Стабилизации Mn(IV) способствуют сильно электроотрицательные анионы, такие как F–, O2–, полидентатные анионы, содержащие элементы в высших степенях окисления (например, периодаты), либо объемные изополианионы ванадия, ниобия, молибдена, вольфрама, образующие с марганцем гетерополисоединения. Наличие у марганца(IV) трех d-электронов (он изоэлектронен Cr3+) обусловливает инертность его соединений, что приводит и к их кинетической стабильности. По этой же причине синтез комплексов марганца(IV) лишь в редких случаях удается провести по обменным реакциям, как правило, для этого требуются окислительно-восстановительные превращения. Большинство комплексов октаэдрические и имеют чисто спиновый магнитный момент 3,87 М.Б., что соответствует трем неспаренным электронам.
Наиболее устойчивым соединением марганца(IV), безусловно, является диоксид MnO2, описанный выше. Образуемые им гидраты, например, MnO2×1/2H2O, встречающийся в природе в виде минерала тодорокита, легко теряют воду и по причине химической инертности не вступают в обменные реакции с кислотами и основаниями. О его амфотерности можно судить косвенно по наличию как катионных, так и анионных форм. Ионы гексааквамарганца(IV) [Mn(H2O)6]4+, подобно другим четырехзарядным гексааквакатионам 3d-металлов, в водных растворах неустойчивы вследствие необратимого гидролиза и высокой окислительной активности. Однако об их окраске мы можем судить по другим соединениям, содержащим марганец(IV) в октаэдрическом поле, образованном атомами кислорода. Примерами служат периодат, образующийся при добавлении сульфата марганца(II) к подкисленному раствору тригидропериодата натрия
MnSO4 + 2Na2H3IO6 = NaMnIO6↓ + NaIO3 + Na2SO4 + 3H2O
либо 9-молибдоманганат(IV) аммония (NH4)6MnMo9O32×6H2O, получаемый из гептамолибдата, перманганата калия и пероксида водорода. Оба эти вещества представляют собой оранжево-красные кристаллические порошки.
При взаимодействии свежеосажденного гидратированного диоксида марганца с горячей 75%-ной иодноватой кислотой из образующегося темнокоричневого раствора выпадает красный осадок комплексной кислоты H2MnIV(IO3)6.2H2O. Получены ее соли M2Mn(IO3)6 c щелочными металлами и аммонием. (Мележик А.В., Павлов В.Л. Журн. Неорган. Химии, 1975, 20, 678). Известны и более сложные периодатные комплексы, например, Na7Mn(HIO6)2(H2IO6)×18H2O (W. Lewason, M.D. Spicer, M. Webster, Inorg. Chem., 1992, 31, 2575). Во всех этих соединениях атом марганца расположен в центре правильного октаэдра MnO6, образованного атомами кислорода иодат- или периодат-ионов, выступающих в роли хелатирующих лигандов (Рис.5.27. Строение аниона в Na7Mn(HIO6)2(H2IO6)×18H2O).
Неорганические соли марганца(IV) крайне неустойчивы и мало изучены. Так, сульфат марганца(IV) Mn(SO4)2, выделяется в вид е черных кристаллов из достаточно крепких сернокислых растворов при добавлении в них сульфата марганца(II) и перманганата калия (Руководство по препаративной неорганической химии, под ред. Г. Брауэра, М., Изд-во Иностр. Лит., 1956, с. 671):
3MnSO4 + 2KMnO4 + 8H2SO4 = 5Mn(SO4)2 + K2SO4 + 8H2O.
Он растворим в 70%-ной серной кислоте с образованием темного раствора, но при разбавлении водой необратимо гидролизуется:
Mn(SO4)2 + 2H2O = MnO2¯ + 2H2SO4.
Фосфат марганца(IV) известен только в виде комплексов [Mn(PO4)2]2–, существующих при высоких концентрациях ортофосфорной кислоты. Любопытным исключением является малорастворимый в воде селенит марганца(IV) Mn(SeO3)2, оранжево-красных кристаллы которого образуются с высоким выходом при взаимодействии пиролюзита или перманаганата калия с диоксидом селена в кипящей воде! Лишь при 400 °C вещество диспропорционирует на селенат марганца(IV) и селенистый ангидрид.
Амфотерный характер гидратированного оксида марганца(IV) проявляется в способности образовывать оксо- и гидроксоанионы, называемые манганатами(IV) или манганитами.
Так, при сплавлении пиролюзита с оксидом кальция получены соединения CaMnO3, Ca2MnO4, Ca2Mn3O8, Ca4Mn3O10 (K.R. Poepplmeier, M.E. Leonowicz, J.C. Scanlon, J.M. Longo, W.B. Yelon, Journ. Solid State Chem., 1982, 45, 71; 1985, 58, 71). Практически во всех манганитах атом марганца находится в октаэдрическом окружении, исключение составляет манганит бария Ba3MnO5, в структуре которого присутствуют тетраэдры MnO4. При нагревании манганиты диспропорционируют:
: 500°C
2K2MnO3 = K3MnO4 + KMnO2.
(Рис. 5.28. Диаграмма системы CaO-MnO2 НАЙТИ!!! МОЖНО ЗАМЕНИТЬ Ca на что-то). Гидроксоманагнатат(IV)-ион трудно получить в растворе, но он известен в природном минерале журавските Ca3[Mn(OH)6](CO3)(SO4).13H2O ярко-желтого цвета.
ДОПОЛНЕНИЕ. Пероксосоединения марганца(IV)
В низших степенях окисления марганец не образует пероксидных соединений, однако пероксоманганаты(IV) известны (Сноска: раньше диоксид марганца ошибочно называли «перекисью марганца» по аналогии с пероксидом бария, имеющим такой же состав. Такое название можно встретить в старой литературe). Они играют важную роль в в процессе фотосинтеза, являясь интермедиатами при окислении воды марагнецсодержащим олигопротеином, а затем распадаясь с выделением кислорода. Марганец присутствует в фотосистеме II, где поглощение излучения обеспечивает энергию для окисления воды, выделения СО2 и переноса электронов в фотосистему I. Здесь осуществляется восстановление никотинамиддинуклеотидфосфата. При этом окисление Mn(II) до Mn(III) и Mn(IV) протекает через образование гидроксо- и пероксокомплексов (Рис.5.29. Предполагаемый механизм окисления воды активным центром марганец-содержащего олигопротеинового комплекса. Показан на модельном соединении с лигандом – 1,4,7-триметил-1,4,7-триазациклононаном). Считается, что «окисляющие воду центры» фотосистемы II содержат по четыре атома Mn в виде плоских или кубановых кластеров, однако точное строение марганец-содержащего олигопротеинового комплекса неизвестно. В последние годы в центре внимания оказались пероксокомплексы марганца со многими модельными соединениями, имитирующими строение активных центров, а также с порфиринами и фталоцианинами (K. Weighardt, Angew. Chem., Int. Ed. Engl., 1989, 28, 1153; V.K. Yachandra, K. Sauer, M.P. Klein, Chem. Rev., 1996, 96, 2927).
Простейшие пероксосоединения марганца изучены гораздо хуже, так как не являлись предметом современных исследований. Доказано (R. Scholder, A. Kolb, Z. Anorg. Allg. Chem., 1949, 260, 231), что при действии манганата(VI) или cоли марганца(II) на охлажденный раствор пероксида водорода в щелочной среде осаждается коричневый кристаллический пероксоманганат(IV) K3[Mn(OH)(O2)3], строение которого неизвестно. Есть сообщения о получении и других пероксокомплексов: K2[Mn(H2O)(O2)3], K4[Mn(O2)4]. Все они неустойчивы и быстро распадаются, выделяя кислород и превращаясь в диоксид марганца. Каталитическое действие соединений марганца на разложение пероксида водорода также, очевидно, связано с образованием неустойчивых пероксосоединений.
КОНЕЦ ДОПОЛНЕНИЯ
ДОПОЛНЕНИЕ. Гетрополисоединения марганца.
Благодаря электронной конфигурации d3, не вызывающей искажения октаэдрического поля, марганец(IV), технеций(IV) и рений(IV) выступают в качестве гетероатомов в большом количестве гетерополисоединений.
Схема образования и взаимных переходов между различными типами гетерополиванадатоманганатов(IV) изображена на рис.5.30. Общий способ их синтеза заключается в обработке нагретых смесей растворов KVO3 и MnSO4 персульфатами щелочных металлов или аммония при различных рН. Выделены красные кристаллы трех типов: тетраванадоманганаты(IV) [K2MnV4O13•4H2O, (NH4)5HMn3V12O39•nH2O], 11-ванадатоманганаты(IV) [K5MnV11O32•nH2O, Cs4,5H0,5Mn11V32•7H2O] и 13-ванадатоманганаты(IV) [K7MnV13O38•18H2O, Na7MnV13O38•29H2O]. Изменения соотношений реагентов и кислотности растворов приводят к взаимным переходам этих соединений друг в друга (рис.5.29). При подщелачивании растворов гетерополианионы разрушаются.
Продуктами взаимодействия ниобатов с ацетатом натрия и пероксидом водорода в щелочной среде являются гетерополи-12-ниобоманганаты(IV). В соединении Na12MnΝb12O38•50H2O анион MnNb12O3812- построен из центрального октаэдра MnO6, окруженного двумя группами Nb6O19, составленными из октаэдров NbO6 (рис.5.31. Структура аниона MnNb12O3812- в Na12MnNb12O38.50H2O). Среднее расстояние Mn-O 0,187 нм, точно такое же, как в периодате NaMnIO6.
При реакциях кипящих растворов парамолибдатов, паравольфраматов или мономерных вольфраматов с MnSO4 и окислителями (персульфатом или пероксидом водорода), образуются несколько типов гетерополисоединений, кислот или их солей. Свободная кислота H6MnMo9O32 известна только в растворе, однако выделены ее кристаллические соли со щелочными металлами, 9-молибдоманганаты(IV), например, [(NH4)6MnMo9O32•nH2O]. При кипячении растворов Na2MoO4 и NaMnO4 с соляной кислотой образуется желтый раствор, из которого введением избытка хлорида аммония осаждают желтые кристаллы 12-молибдоманганата(IV), (NH4)3HМnMo12O40. При повышении рН растворов соединения полностью разрушаются с осаждением диоксида MnO2 и образованием растворимых молибдатов. Аналогично получены 12-вольфрамоманганаты(IV), например, K4MnW12O40•20H2O. Описаны и другие типы гетерополисоединений, в частности, пентавольфрамоманганаты(IV), Na6MnW5O20•18H2O.
КОНЕЦ ДОПОЛНЕНИЯ
Многие комплексные соединения Mn(IV) обладают сильными окислительными свойствами. Это неудивительно, так как для более высоких степеней окисления марганца комплексы нехарактерны. Цианидный комплекс марганца(IV) K2[Mn(CN)6] желтого цвета образуется при окислении гексацианоманганата(III) хлористым нитрозилом в диметилформамиде. Он является сильным окислителем, неустойчивым в водном растворе. Ацетилцетонат марганца(IV) известен только в форме неустойчивого катиона [Mn(acac)3]+, образующегося при электрохимическом окислении трис-ацетилацетоната марганца(III) в ацетонитриле.
Для марганца характерно образование многоядерных комплексов, в состав которых одновременно входит несколько атомов металла. Такие соединения обычно стабилизируются оксо- и ацетатными мостиками, а также ди – и полиаминами. Простейший диядерный оксалатный комплекс получают аналогично трис-комплексу марганца(III), но при другом соотношении реагентов (Y. Yoshino, I. Taminaga, M.Kokiso, T. Uehiro, Bull. Chem. Soc. Jаpаn, 1974, 47, 2787):
2KMnO4 + 6H2C2O4 + K2C2O4 = K4[Mn2O2(C2O4)4] + 3CO2 + 6H2O.
Выделяющиеся зеленые кристаллы тетрагидрата устойчивы при пониженной температуре в темноте в течение недели. (Рис.5.32. Строение аниона [Mn2O2(C2O4)4]4–).
Черно-коричневые гидратированные диоксиды технеция TcO2.2H2O и рения ReO2.2H2O осаждаются при восстановлении водных растворов пертехнетатов и перренатов водородом в момент выделения, солями олова(II) или электрическим током. Они не имеют постоянного состава и в водных растворах не проявляют ярко выраженных кислотно-основных свойств. Дегидратацией в вакууме при 250-300 оС их переводят в оксиды. Другим методом синтеза служит гидролиз хлоридных комплексов K2TcCl6, K2ReCl6 :
K2TcCl6 + H2O = TcO2.2H2O + 2KCl + 6HCl,
осуществляемый при кипячении в инертной атмосфере, а для диоксида рения - также и гидролиз высших хлоридов ReCl4 и ReCl5:
3ReCl5 + 12H2O = 2ReO2.2H2O + HReO4 + 15HCl.
При обработке дигидрата ТсО2.2Н2О концентрированными растворами щелочей образуются оранжевые растворы, содержащие гидроксокомплексы [Тс(ОН)6]2–:
TcO2.2H2O + 2KOH = K2[Tc(OH)6].
Они легко окисляются в пертехнетаты пероксидом водорода, бромной водой, солями церия(IV). Диоксид рения ReO2 устойчив к действию растворов щелочей, но при сплавлении в вакууме реагирует с ними. В продуктах реакции найдены коричневые рениты, например, Li2ReO3 (R.J. Cava, A. Santoro, D.W: Murphy, S. Zahurak, R.S. Roth, J. Solid State Chem., 1982, 42, 251). Если сплавление проводить на воздухе, образуются перренаты. По сравнению с диоксидом марганца, гидратированные оксиды технеция(IV) и рения(IV) гораздо более слабые окислители, о чем свидетельствует их взаимодействие с соляной кислотой, приводящее к хлоридным комплексам Н2МCl6 (см. раздел оксиды). Восстановительные свойства диоксидов технеция и рения выражены значительно сильнее, чем у MnO2: сильные окислители (HNO3, KMnO4, H2O2, HClO3) переводят их в анионы технециевой и рениевой кислот:
Дата добавления: 2016-01-03; просмотров: 3424;
