Кислоты, гидроксиды, соли и комплексные соединения. 1 страница
Разнообразие степеней окисления, особенно характерное для марганца, а также амфтерный характер соединений в степенях окисления ниже +5, обусловливает существование большого количества анионных и катионных форм, многие из которых устойчивы в водных растворах. Химия марганца в высших степенях окисления (+5, +6, +7), наоборот, фактически ограничена манганат-ионами MnO4n–, n = 1 – 3, входящими в состав различных солей. Их традиционные названия, приведенные в таблице 5.3, в соответствии с нормами современной номенклатуры все чаще заменяют термином манганат с указанием степени окисления марганца в скобках.
Таблица 5.3. Типы кислородных соединений марганца в различных степенях окисления.
| Степень окисления | Оксид | Гидроксид | Характер | Катионные формы | Анионные формы |
| +2 | MnO | Mn(OH)2 | основный, слабо амфотерный | MnSO4 | Li2MnO2 Li4[Mn(OH)6] |
| +3 | Mn2O3 | MnOOH Mn2O3×xH2O | амфотерный | Mn2(SO4)3 | LiMnO2 Li3[Mn(OH)6] |
| +4 | MnO2 | MnO2×xH2O | амфотерный | Mn(SO4)2 | Li2MnO3 (манганиты) |
| +5 | – | [H3MnO4] | кислотный | – | Li3MnO4 (гипоманганаты) |
| +6 | – | [H2MnO4] | кислотный | – | Li2MnO4 (манганаты) |
| +7 | Mn2O7 | HMnO4 | кислотный | – | LiMnO4 (перманганаты) |
Степень окисления +2 (d5).
Эта степень окисления наиболее широко представлена у марганца: соединения марганца(II) часто наиболее устойчивы в водных растворах. Химия Тс(II) и Re(II) преимущественно представлена комплексными соединениями, главным образом с фосфинами.
Элменты группы марганца в степени окисления +2 имеют электронную конфигурацию d5, что соответствует наполовину заполненному d-подуровню. Энергетически наиболее устойчивыми оказываются высокоспиновые комплексы (t2g3eg2), в которых достигается большой выигрыш в энергии кристаллизации кристаллическим полем и не требуется затрат энергии на спаривание электронов.
Ион Mn2+ в слабом октаэдрическом поле имеет высокосимметричное расположение элетронов, каждый из которых занимает одну из пяти d-орбиталей. Под действием кванта энергии между t2g и eg орбиталями обычно происходят электронные переходы. Однако, в данном случае любой такой переход приведет к спариванию электронов и к понижению симметрии. Поэтому все электронные d-d переходы из высокоспиновой конфигурации d5 со спариванием электронов запрещены по спину, то есть маловероятны:
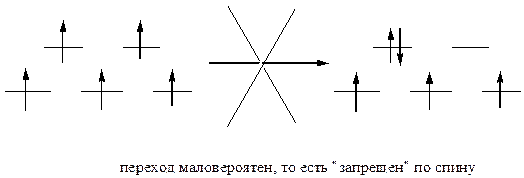
В то же время, как известно, именно d-d переходы и обусловливают окраску ионов переходных металлов. Таким образом, для высокоспиновых октаэдрических комплексов марганца(II) следует ожидать слабую окраску или даже ее отсутствие. В случае искажения октаэдрической геометрии запреты снимаются, и реализуются электронные переходы с появлением интенсивной окраски. Это наблюдается в комплексах с разными лигандами.
Наличие пяти неспаренных электронов вызывает появление парамагнитных свойств ионов. Большинство измеренных магнитных моментов соответствует чисто спиновому значению 5,92 μВ. Такая высокоспиновая октаэдрическая координация реализуется в подавляющем большинстве неорганических и комплексных соединений. Примером может служить акваион [Mn(H2O)6]2+ бледно-розового цвета.
В разбавленных водных растворах нитрата марганца(II) гексаакваионы окружены второй более слабо ассоциированной сольватационной оболочкой из 18 молекул Н2О, образующих с внутрисферными молекулами воды систему водородных связей: {[Mn(OH2)6](OH2)18}2+. Гидратная оболочка не зависит от иона нитрата, который не гидратируется. В концентированных растворах вода участвует прежде всего в насыщении первой гидратной оболочки Mn2+, и остающиеся молекулы воды и ионы нитрата статистически размещаются между плотно упакованными комплексами [Mn(H2O)6]2+. В 6,4 молярном растворе Mn(NO3)2 вся вода употребляется для насыщения гидратных оболочек Mn2+, и в этих растворах сохраняется структура твердого Mn(NO3)2.6H2O , содержащая гексакваионы. (Strother E.F., Farach H.A., Poole C.P. Phys. Rev. A, 1971, 4, No 3, 2078).
Высокоспиновые октаэдрические комплексы марганца(II) являются лабильными, поэтому в водных растворах существуют сложные равновесия между аква-ионами, продуктами их гидролиза и замещения молекул воды на анионы кислотных остатков, споосбные выступать в роли лигандов.
В растворах хлорида марганца(II), кроме гидратированного иона Mn2+, присутствуют хлорокомплексы и аквахлорокомплексы общего состава [Mn(H2O)6-nCln]2-n (n = 1, 2, 3), а также продукты гидролиза, прежде всего [Mn(H2O)5OH]+ (см. ниже.). В сильно разбавленных растворах Mn2+ окружен 6 молекулами воды. Начиная с концентрации 0,5 М молекулы воды в гидратной оболочке постепенно замещаются на хлорид-ионы, что приводит к образованию частиц [MnCl(H2O)5]+ и [Mn(H2O)4Cl2]. При концентрации хлорид-ионов Cl– выше 5M преобладают октаэдрические анионы [MnCl3(H2O)3]-, [MnCl4(H2O)2]2–, [MnCl6]4– а при их огромном избытке – тетраэдрические комплексы [MnCl4]2–. В этих ионах также возможно замещение хлора на молекулы воды: [MnCln(H2O)4-n]2-n (n = 1, 2, 3). (Тишков П.Г., Вишневская Г.П. Журн. Эксперим. и Теор. Физики, 1960, 38, 335).
Гидроксид марганца(II), выпадающий в виде белого осадка при действии щелочей на водные растворы солей марганца(II) (рН осаждения 8,7), на воздухе быстро окисляется:
4Mn(OH)2 + O2 = 4MnOOH¯ + 2H2O,
поэтому его синтез ведут в инертной атмосфере. Более сильные окислители, такие как бромная вода, гипохлорит, переводят его в пиролюзит:
Mn(OH)2 + Br2 + 2NaOH = MnO2¯ + 2NaBr + 2H2O
В отличие от большинства гидроксидов переходных металлов, гидроксид имеет стехиметрический состав, отвечающий формуле Mn(OH)2, и изоструктурен гидроксиду магния. Он является основанием средней силы (Kb = 5,0×10–4), превосходящим аммиак, поэтому в присутствии ионов аммония переходит в раствор.
Слабый амфотерный характер гидроксида марганца(II) проявляется в его способности образовывать анионные гидроксо-комплексы:
Mn(OH)2 + OH–  [Mn(OH)3]–, K ~ 10–5
[Mn(OH)3]–, K ~ 10–5
Так, при взаимодействии с кипящим концентрированным раствором едкого натра в инертной атмосфере образуется тетрагидроксоманганат(II) Na2[Mn(OH)4]. Известны и манганаты(II), полученные твердофазным синтезом, например, K2Mn2O3 (E. Seipp, R. Hoppe, Z. Anorg. Allg. Chem., 1985, 530, 117) (Рис.5.19. Строение K2Mn2O3) , Na14Mn2O9 (G. Brachtel, R. Hoppe, Z. Anorg. Allg. Chem., 1987, 438, 97).
По некоторым свойствам соединения марганца(II) напоминают аналогичные соединения магния, что обусловлено достаточно близкими ионными радиусами (Mn2+ 0,091 нм, Mg2+ 0,074 нм), повышенной устойчивостью наполовину заполненного d-подуровня, нулевой энергией стабилизации кристаллическим полем. Сходство между соединениями магния и марганца(II) включает сходные растворимости солей и формулы кристаллогидратов, близкие значения произведений растворимости и констант основности гидроксидов (pKb Mn(OH)2 = 3,30; pKb Mg(OH)2 = 2,60). Подобно магнию, марганец образует белый осадок марганецаммонийфосфата, который при прокаливании переходит в пирофосфат:
MnSO4 + (NH4)2HPO4 + NH3 + H2O = (NH4)MnPO4×H2O¯ + (NH4)2SO4
(NH4)MnPO4×H2O = Mn2P2O7 + 2NH3 + 3H2O.
Взаимодействием гидроксида марганца(II) с кислотами получают разнообразные соли. В отличие от гидроксида, все они устойчивы к окислению кислородом воздуха. Это легко заметить, сравнивая значения стандарных электродных потенциалов при рН = 0 (E0(Mn3+/Mn2+ = 1.51 B) и рН = 14 (E0(Mn(OH)3/Mn(OH)2 = 0.1 B). Соли марганца(II) образуют гидраты, окрашенные в бледно-розовый цвет, свойственный катионам [Mn(H2О)6]2+ . Они входят в состав некоторых гидратов, например, MnSO4×7H2O, Mn(ClO4)2×6H2O, Mn(NO3)2×6H2O. В водных растворах солей марганца(II) протекает гидролиз:
[Mn(H2О)6]2+ + Н2О  [Mn(H2O)5OH]+ + H3О+, К = 5×10–5
[Mn(H2O)5OH]+ + H3О+, К = 5×10–5
Интересно, что гидролиз растворов галогенидов марганца при нагревании раствора ослабевает, что связано с замещением гидроксид-ионов в координационной сфере металла на галогенид-ионы.
Cульфат марганца(II) в безводном виде представляет собой порошок белого цвета. Его кристаллогидраты образуют розовые кристаллы. Ниже 9 °C из растворов кристаллизуется гептагидрат, содержащий гексаакваионы, между 9 и 24 °C пентагидрат, (марганцовый купорос), изоструктурный медному купоросу, выше 24 °C – моногидрат. Полное обезвоживание наступает лишь при 200 °C. При хранении марганцовый купорос, подобно медному купоросу, выветривается, теряя молекулу внешнесферной воды и, таким образом, превращаясь в тетрагидрат. Безводный сульфат марганца(II) разлагается выше температуры плавления (700 °C):
900 °C
3MnSO4 = Mn3O4 + 3SO2 + O2.
Из сернокислых растворов сульфата марганца(II) кристаллизуется кислая соль Mn(HSO4)2. Известны двойные сульфаты с щелочными металлами, например, K2Mn(SO4)2(H2O)4, K2Mn3(SO4)2(H2O)5.
Действие на растворы солей марганца сульфитами щелочных металлов приводит к осаждению основных солей (см. т.2, стр. 258), например, NaMn2OH(SO3)2H2O (W. Buchmeier, B. Engelen, H.D. Lutz, Z. fuer Naturforsch., 1986, 41, 852). Средний сульфит MnSO3 получают, пропуская ток сернистого газа через водную суспензию карбоната магния.
При осаждении ионов Mn2+ растворами сульфидов выпадает осадок телесного цвета, представляющий собой гидратированный сульфид марганца(II) MnS×xH2O. Хотя кристаллическая структура этого продукта неизвестна, бледно-розовая окраска свидетельствует о том, что молекулы воды дополняют координационную сферу марганца до октаэдра. При хранении на воздухе осадок постепенно окисляется, превращаясь в пиролюзит, а в инертной атмосфере теряет кристаллизационную воду, приобретая зеленый цвет, свойственный природному минералу – алабандину (α-MnS), имеющему структуру NaCl. Сульфид марганца (ПР 10–14) растворим даже в разбавленных кислотах и поэтому не может быть осажден сероводородом. Известны также две кристаллические красные модификации, одна – со структурой вюрцита (γ-MnS), другая – сфалерита (β-MnS). β-Модификацию получают, пропуская сероводород в холодный крепкий раствор ацетата марганца(II). При нагревании обе красные модификации переходят в α-MnS. Красно-коричневый дисульфид марганца, или марганцовый колчедан MnS2, изоструктурен пириту. Он образован ионами Mn2+ и S22-. Получение дисульфида из простых веществ невозможно, для его синтеза водный раствор сульфата марганца(II) и спиртовой раствор полисульфида натрия помещают в автоклав при 170 оС на несколько суток. Начиная с 250 оС, твердый дисульфид разлагается на α-MnS и пары серы.
Нитрат марганца выделяется из растворов в виде розоватых игольчатых кристаллов гексагидрата Mn(NO3)2×6H2O, растворимых в воде и спирте. При нагревании до 40 °C они превращаются в моногидрат (Рис.5.20. Фазовая диаграмма системы Mn(NO3)2 – H2O), который при 160 °C разлагается:
Mn(NO3)2×H2O ¾® MnO2 + 2NO2 + H2O.
Безводную соль получают обезвоживанием моногидрата азотным ангидридом, выдерживанием его в глубоком ваккууме ниже температуры разложения или взаимодействием марганца с N2O4.
Действием на раствор соли марганца дигидрофосфатом натрия в среде, близкой к нейтральной, удается осадить белый осадок среднего ортофосфата Mn3(PO4)2×7H2O. В сильно щелочной среде осаждаются основные соли, например, Mn2(OH)PO4, Mn5(OH)4(PO4)2. Известны также различные кислые фосфаты, например, Mn(H2PO4)2×H2O, хорошо растворимый в воде (M.D. Marcos, P. Amoros, F. Sapina, D. Beltran, Journ. Alloys Compd., 1992, 188, 133), и малорастворимый MnHPO4×3H2O (Y. Cudennec, A. Riou, Y. Gerault, Acta Cryst. C., 1989, 45, 1411).
При действии на растворы солей марганца(II) раствором карбоната натрия образуется белый осадок карбоната MnCO3, содержащий лишь незначительное количество основной соли. Чтобы избежать ее образование, осаждение проводят гидрокарбонатом. Интересным методом синтеза MnCO3×H2O является взаимодействие растворимой соли марганца с мочевиной в водном растворе при 80 °C. Образующийся в растворе при комнатной температуре комплекс с мочевиной (urea) при нагревании разлагается (E.M. Nour, S.M. Teleb, N.A. Al-Khsosy, M.S: Refat, Transition Metal Chem., 1997, 22, 505):
[Mn(urea)4](NO3)2 + 6H2O ¾¾® MnCO3×H2O¯ + 3CO2 + 2NH4NO3 + 6NH3.
Карбонат марганца(II) встречается в природе в виде минерала марганцового шпата. При слабом нагревании (150 °C) в инертной атмосфере он разлагается на оксид MnO и углекислый газ. Если разложение проводить на воздухе, в продуктахм реакции появляется Mn3O4. Растворимость MnCO3 возрастает в 250 раз при насыщении воды углекислым газом. Как и в случае карбонатов магния и щелочноземельных металлов, это объясняется образованием кислой соли, известной лишь в растворе:
MnCO3 + CO2 + H2O = Mn(HCO3)2.
Силикаты марганца(II) MnSiO3 (родонит), Mn2SiO4 (тефроит) и Mg5(SiO4)2(OH)2 (аллеганиит) встречаются в природе. Они входят в состав шлаков, образующихся в доменном процессе при использовании ферромарганца в качестве раскислителя.
Тетрагидрат ацетатата марганца(II), Mn(CH3COO)2×4H2O, выделяется в виде розово-красных игл из раствора, полученного взаимодействием карбоната марганца с уксусной кислотой. Вещество образовано цепями атомов марганца, соединенных ацетатными мостиками и молекулами воды (Рис.5.21. Строение ацетата марганца(II)).
При взаимодействии суспензии карбоната марганца(II) с горячим раствором щавелевой кислоты осаждается белый кристаллический порошок оксалата марганца MnC2O4×2H2O (известен и тригидрат). При нагревании до 100 °C он теряет воду, а затем разлагается на MnO, CO2 и CO. Растворимость оксалата марганца в воде повышается в присутствии оксалатов щелочных металлов за счет образования анионных комплексов:
Mn2+ + C2O42–  MnC2O4, K = 3×104
MnC2O4, K = 3×104
MnC2O4 + C2O42–  [Mn(C2O4)2]2–, K = 1×102
[Mn(C2O4)2]2–, K = 1×102
[Mn(C2O4)2]2– + C2O42–  [Mn(C2O4)3]4–, K = 32
[Mn(C2O4)3]4–, K = 32
В твердом виде получены вещества, содержащие ионы [Mn(C2O4)2(H2O)2]2– и [Mn2(C2O4)3(H2O)2]2–. Интересно, что твердые трисоксалатоманганаты(II) неизвестны.
Устойчивость высокоспиновых комплексных соединений марганца(II), имеющих нулевую энергию стабилизации кристаллическим полем, не всегда коррелирует с положением лиганда в спектрохимическом ряду. Так, например, аммино-комплексы, согласно значениям констант устойчивости, оказываются менее стабильными, чем гидроксо-комплексы. В то же время, для соединений маргнаца(III) стабилизация кристаллическим полем играет существенную роль. Это приводит к ярко выраженной зависимости между окислительно-восстановительной активностью комплексов марагнца(II) и силой лиганда: чем в более сильном поле расположен лиганд, тем менее устойчивым к окислению оказывается комплекс. Если комплексы с лигандами слабого поля, например, [Mn(H2O)4Cl2], K2[Mn(C2O4)2(H2O)2] устойчивы к окислению кислородом воздуха, то аммиакаты и ацетилацетонат марганца(II) на влажном воздухе быстро окисляются. Наблюдается общая закономерность: чем в более сильном поле расположен лиганд, тем менее устойчив к окислению его комплекс с марганцем(II).
При действии на соли марганца(II) избытком водного раствора аммиака выпадает осадок гидроксида, однако часть марганца остается в растворе в виде аммино-комплексов:
[Mn(H2O)6]2+ + NH3  [Mn(H2O)5(NH3)]2+ + H2O, K = 0.16.
[Mn(H2O)5(NH3)]2+ + H2O, K = 0.16.
Ион гексааминомарганца(II) удается зафиксировать лишь в растворе с концентрацией NH3 выше 2М, поэтому этот метод не находит применения в синтезе. Аммиакаты марганца(II) обычно получают в среде жидкого аммиака или пропусканием газообразного аммиака над нагретой твердой солью:
MnCl2 + 6NH3 = [Mn(NH3)6]Cl2.
Они представляют собой бесцветные порошки, буреющие на воздухе вследствие окисления. В водных растворах часть молекул аммиака замещается на молекулы воды. При взаимодействии марганца с раствором калия в жидком аммиаке образуются амидные комплексы:
Mn + 2K + 4NH3 = K2[Mn(NH2)4] + 2H2↑.
Они довольно устойчивы в сухом виде, но мгновенно разлагаются водой.
Бледно-желтый осадок дигидрата ацетилацетоната марганца(II) Mn(acac)2(H2O)2, полученный в водно-спиртовом растворе по обменной реакции между солью марагнца и ацетилацетонатом щелочного металла, в сухом виде сохраняется долго, однако в присутствии влаги быстро окисляется. При нагревании в вакууме он теряет воду, а затем сублимируется в форме тримера Mn3(acac)6 (Shibata S., Onuma S., Inoue H. Inorg. Chem., 1985, 24, 1723).
Нулевая энергия стабилизация кристаллическим полем означает также, что геометрия образующегося комплекса определяется только стерическими факторами, то есть размером лиганда. Чем крупнее лиганд, тем более вероятно, что комплекс с его участием представляет собой тетраэдр, например, [MnCl4]2–. d-d переходы в тетраэдрических комплексах с конфигурацией d5 более вероятны, чем в октаэдрических, так как тетраэдр не имеет центра симметрии, поэтому для них характерна более интенсивная окраска, обычно желтая или зеленая. Таким образом, отличить октаэдрический комплекс от тетраэдрического часто удается по внешним признакам.
Все рассмотренные выше комплексные соединения являются высокоспиновыми. Спаривание спинов в Mn(II) требует затраты энергии, и поэтому становится благоприятным только под действием лигандов сильного поля, таких как цианид CN– или нитрил CNR. В низкоспиновых комплексах [Mn(CN)6]4- и [Mn(CNR)6]2+ с электронной конфигурацией t2g5eg0 из-за сильного π-связывания связь металл-лиганд приобретает существенный ковалентный характер, а центральный атом становится чувствительным к окислению. Темно-фиолетовые кристаллы гексацианоманганата марганца(II) К4[Mn(CN)6] на влажном воздухе превращаются в темно-красный К3[Mn(CN)6]:
4K4[Mn(CN)6] + O2 + 2H2O = 4K3[Mn(CN)6] + 4KOH.
Они еще менее устойчивы к окислению, чем гидроксо- и амминокомплексы
Разнообразие комплексных соединений марганца(II) обусловлено высокой устойчивостью высокоспинового состояния с пятью неспаренными электронами. В то же время, у других металлов седьмой группы, расположенных в пятом и шестом периодах, высокоспиновые комплексы не могут существовать из-за высокой энергии расщепления. Как и в случае марганца, стабилизация низкоспинового состояния может быть достигнута преимущественно в комплексах с π-акцепторными лигандами – цианидом, пиридином, нитрилами, фосфинами и арсинами, например, МCl2(py)4, [MCl2(diars)2], где diars - 1,2-диметиларсинобензол, выступающий в роли бидентного хелатирующего лиганда. Часто комплексы технеция(II) и рения(II) сходны между собой по строению и свойствам. В них низшая степень окисления стабилизирована π-связыванием между атомом металла и лигандом.
Большинство таких соединений получают восстановлением комплексов технеция(III) и рения(III), например, фосфорноватистой кислотой Н3РО2 , хлоридом олова(II), электрохимически.
При восстановлении гексахлоротехнетата(IV) гидроксиламином образуется комплексный катион Тс(II):
[TcCl6]2- + 4NH2OH + 5NH3 = [Tc(NH2OH)2(NH3)3]2+ + 6Cl- + N2↑ + 2H2O + 2NH4+.
Многие комплексные соединения технеция(II) и рения(II) стабилизированы за счет образования кратных связей металл-металл. Так, при обработке иона [Tc2Cl8]2- тетрафтороборной кислотой HBF4 в ацетонитриле выделен синий комплекс [Tc2(CH3CN)10](BF4)4 с тройной связью Тс≡Тс длиной 2,122 А. Фосфиновые лиганды способны стабилизировать низкие степени окисления путем делокализации электронной плотности от металла на лиганды. Благодаря высокой электронной плотности между атомами металла эти комплексы участвуют в восстановлении органических соединений, в реакциях окислительного присоединения. В твердом виде они медленно реагируют с кислородом, окисляясь вплоть до степени окисления +5 без изменений в координационной сфере. (J. Inorg. Chem., 1995, 34, 1880 ) Авторы ???
Рис.5.22. Строение комплексов [Tc2(CH3CN)10]4–, Re2Cl4(μ-Ph2PCH2PPH2)
Степень окисления +3d4).
Марганец в степени окисления +3 может быть стабилизирован в виде оксида и гидроксида, практически нерастворимых в воде, а также в форме разнообразных комплексных соединений, устойчивость которых возрастает по мере увеличения силы лиганда. Большинство этих комплексов октаэдрические и высокоспиновые, независимо от входящих в их состав лигандов. Поэтому магнитные моменты комплексов близки к чисто спиновому значению 4,90 μВ для четырех неспаренных электронов.
Электронная конфигурация d4 иона Mn3+, относящегося к ян-теллеровским ионам, приводит к искажению октаэдрических комплексов, преимущественно за счет удлинения двух связей, расположенных в транс-положении друг к другу. Все комплексы марганца(III) лабильные.
Гексаакваион [Mn(H2O)6]3+ образуется при анодном окислении солей марганца(II), а также при восстановлении водных растворов перманганатов. По-видимому, он является интермедиатом во многих окислительно-восстановительных превращениях, включая окисление Mn2+ персульфатом. В твердом виде он охарактеризован в цезий-марганцевых квасцах [Cs(H2O)6][Mn(H2O)6](SO4)2, кораллово-красный цвет которых связывают с окраской этого иона. (Сноска: в структуре квасцов ян-теллеровское искажение иона [Mn(H2O)6]3+ не обнаружено). Подобно другим трехзарядным катионам металлов первого переходного ряда, в водных растворах он значительно гидролизован:
[Mn(H2O)6] 3+ + H2O  [Mn(H2O)5OH] 2+ + H3O+, K = 0.93.
[Mn(H2O)5OH] 2+ + H3O+, K = 0.93.
Возможно, при этом образуются также и полиядерные гидроксокомплексы. При попытке концентрирования растворы мутнеют вследствие образования аморфного гидроксида переменного состава. Высказано предположение, что грязно-зеленый цвет растворов, образующихся при анодном окислении солей марганца, как раз и обусловлен окраской не гексаакваиона, а продуктов его гидролиза.
Даже разбавленные водные растворы, содержащие [Mn(H2O)6]3+ ( E0(Mn3+/Mn2+ = 1.56 B) неустойчивы вследствие окисления им воды:
4[Mn(H2O)6] 3+ + 2H2O = 4[Mn(H2O)6]2+ + 4H+ + O2.
Параллельно с этим, как видно из диаграммы Фроста (Рис.5.2), возможно также его диспропорционирование:
2[Mn(H2O)6] 3+ = [Mn(H2O)6] 2+ + MnO2¯ + 4H+ + 4H2O.
Гидроксид марганца(III) образуется в виде бурого осадка переменного состава при окислении гидроксида марганца(II) кислородом воздуха. Первоначально образующийся продукт содержит атомы марганца в двух степенях окисления - +2 и +3 и отвечает составу MnOx×nH2O, где x = 1.35 – 1.44, примерно соответствующему гидратированному гауcманниту (В.П. Чалый, Гидроокиси металлов, Киев. Наукова думка, 1972, с. 34). При стоянии он превращается в форму оксогидроксида MnOOH, известного в виде двух модификаций – ромбической (γ-MnOOH, манганит) и моноклинной (α-MnOOH, гроутит).
В структуре манганита каждый атом марганца находится в центре октаэдра MnO6. Отдельные октаэдры объединены друг с другом в гофрированные слои, соединенные водородными связями, в которых участвуют только ОН-группы: -O-H…O(H)-. Такое же строение имеют бемит γ-AlOOH и лепидокрокит γ-FeOOH. В структуре гроутита октаэдры MnO6 соединены общими ребрами в двойные цепи, сочлененные отдельными вершинами в трехмерный каркас и дополнительно сшитые водородными связями. В отличие от структуры γ-модификации, здесь они образованы между гидроксилом и оксо-группой: -O…H-O. Аналогичное строение имеют диаспор α-AlOOH, монтрозеит α-VOOH, гетит α-FeOOH.
Рис.5.23. Строение (а) α-MnOOH, (б) γ-MnOOH
Дата добавления: 2016-01-03; просмотров: 5763;
