Понятие о вяжущих веществах.
| Минеральные (известь, гипс, цемент) |
| Вяжущие вещества |
| Органические (битумы, смолы и др.) |
Неорганическими (минеральными) веществами называют соединения кальция, порошкообразные вещества, образующие при смешивании с водой пластичную легко затвердевающую высокомолекулярную массу. Их используют для приготовления строительных растворов.
Органические вяжущие вещества способны переходить в пластическое состояние под действием температуры, либо при растворении в органических растворителях.
По условиям твердения и водостойкости продуктов неорганические вяжущие вещества делятся на воздушные и гидравлические.
1. Воздушные вяжущие вещества
К воздушным вяжущим веществам относятся вещества, которые после замешивания с водой твердеют на воздухе и продукты, твердения которых недостаточно стойки к воде. К ним относятся: воздушная известь, жженый гипс, магнезиальные вяжущие и др.
Оксид кальция (CaO) – воздушная, негашеная или жженая известь. Получают ее обжигом при 1000-1100 оС кальциево-магниевых горных пород (известняков, мела, ракушечников и др.):
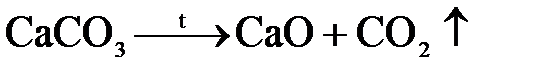
декарбонизация
Химически чистый оксид кальция представляет собой бесцветные кристаллы. Однако оксид кальция с примесями кремнезема, глинозема, карбоната магния имеет разрыхленную аморфную структуру, что обеспечивает ему высокую реакционную способность.
Гидроксид кальция Са(ОН)2 – известь гашеная. Получают её при взаимодействии негашеной извести с водой:
| гашеная известь |
| негашеная известь |
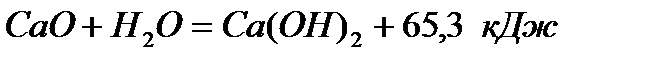
Для гашения берут не теоретически рассчитанное по уравнению реакции воды, а примерно в 2 раза больше, т.к. в процесс гашения вода испаряется, а недостаток воды снижает качество получаемого продукта.
Гидроксид кальция, полученный при обработке CaO при высокой температуре, образует рыхлый порошок, в котором на пустоты приходится 75% объема и только 25% самой извести. Такой продукт называется «пушонкой».
Аморфный порошок гидроксида кальция в присутствии воды переходит в коллоидное состояние и образует вязкий коллоидный раствор, который используют для побелки помещений.
Известковый раствор (смесь гашеной извести с песком и водой) применяют при кладке кирпичных стен и для штукатурки.
Вяжущие свойства гашеной извести как строительного материала основаны на постепенном твердении известковых растворов вследствие кристаллизации гидроксида кальция и превращения его под действием углекислого газа воздуха в прочную массу карбоната кальция CaCO3:
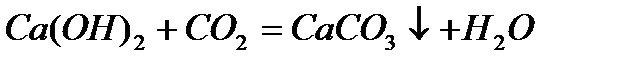
карбонизация
Песок также взаимодействует с известью, образуя чрезвычайного прочный силикат кальция CаSiO3:

Эта реакция протекает медленно. Так как в результате эти реакции сопровождаются выделением воды, поэтому в новых зданиях долго сохраняется сырость.
Гипс
Другим соединением кальция, применяемым в качестве вяжущего строительного материала, является строительный (жженый) гипс 2СаSO4 ∙0,5Н2О. Он получается путем и прокаливания природного гипса СаSO4 ∙2Н2О при 150-180 оС:
| природный гипс (двуводный) |
| строительный гипс (полуводный) |
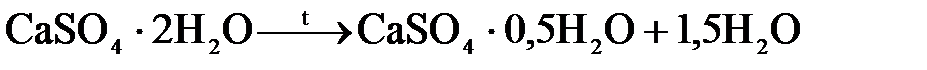
Строительный гипс – быстротвердеющее вяжущее вещество. При замешивании строительного гипса с водой получается тестообразная масса, которая твердеет вследствие его гидратации и образования кристаллического гипса СаSO4 ∙2Н2О (протекает обратная реакция), т.к. двуводный гипс является наиболее устойчивой формой сульфата кальция.
Строительный гипс применяют для штукатурных работ, а также в производстве строительных деталей и конструкций.
2. Гидравлические вяжущие вещества
Гидравлические вяжущие вещества могут твердеть и длительно сохранять свою прочность как на воздухе, так и в воде. К ним относят цемент, гидравлическую известь, гидравлический гипс и др.
Цемент
Цемент получают обжигом при 1400-1600 оС тонкоизмельченной искусственной смеси глины и известняка или же природного мергеля (глинистый известняк), если он по составу удовлетворяет требованиям цементного производства. Получающийся продукт (клинкер) измельчают в порошок.
Основная масса цемента состоит из сложных химических соединений кальция, магния, кремния, алюминия и железа. Химический состав цементов выражают в виде оксидов:
3СаО∙SiО2 (Са3SiO5), 2СаО∙SiO (Са2SiO3), 3СаО ∙Аl2O3 (Са3Аl2 О6),
2СаO ∙Fe2O3 (Са2Fe2O5)
Кроме того, в цементе всегда в переменных количествах содержатся различные примеси.
Количество цемента в значительной степени определяется количественным соотношением отдельных оксидов, входящих в его состав. Для характеристики цемента вычисляют так называемый гидравлический модуль, или, сокращенно, гидромодуль (Н), представляющий собой соотношение процентного содержания основных и кислотных оксидов в цементе:
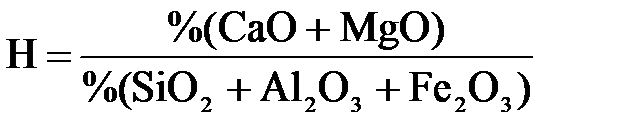
Амфотерные оксиды Al2O3 и Fe2O3 по отношению к сильным основным оксидам CaO и MgO играют роль кислотных.
Гидромодуль колеблется от 1,70 до 2,40. Для хороших цементов он равен двум.
В зависимости от относительного содержания в цементе оксидов SiO2 и Al2O3 различают силикатный (портландцемент) и алюминатный (глиноземистый цемент). Портландцемент – это цемент общего назначения, а глиноземистый цемент более дорогой, чем силикатный, и его чаще используют для гидротехнических и подводных работ.
В строительстве цемент смешивают с песком в соотношении 1:3. Из этой смеси с водой готовят полужидкое тесто. Вода взаимодействует с безводными соединениями цемента, протекают процессы гидролиза и гидратации, например:
Гидролиз трехкальциевого силиката Са3SiO5 (3СаО∙ SiO2) протекает по первой ступени по уравнению:

Поскольку при гидролизе образуется сильное основание Са(ОН)2, цементное тесто имеет щелочную среду.
Образовавшейся двухкальциевый силикат CaSiO4 (2CaO ∙ SiO2) гидратируется:
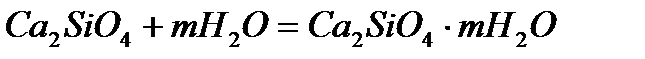
Раствор быстро становится перенасыщенным относительно гидроксида кальция, вскоре образуются кристаллы Са(ОН)2, а вокруг них накапливается студенистый двухкальциевый гидросиликат. Полужидкое тесто постепенно теряет свою подвижность, затем теряет пластичность и переходит в плотное состояние, однако еще не обладающее механической прочностью, происходит, как говорят, схватывание цемента. После этого наступает процесс отвердевания массы: плотное вещество переходит в камневидное состояние, приобретая большую механическую прочность. Цемент твердеет обычно в течение нескольких суток, а то и недель.
Замечательно отношение цемента к воде. Вода разрушает почти все материалы в природе (камень, металлы, дерево и т.д.), а цемент от действия воды упрочняется, причем укрепление постепенно идет десятки лет.
При смешивании цементной массы с гравием, щебнем, шлаком и др. подобными материалами, образуется твердая масса, которая называется бетоном. Если этой массой залить железную арматуру, то образуется железобетон. Бетон и железобетон применяются как строительные материалы.
3. Коррозия вяжущих материалов.
Изучение сооружений, находящихся в самых различных условиях действия внешней среды и построенных из различных материалов, показывает, что они далеко не вечны. Химические и физико-химические процессы, идущие на их поверхности с окружающей средой, или внутренние процессы между составляющими цементного камня, между поровой жидкостью и заполнителем приводят к нарушению его монолитности и преждевременному выходу сооружения из строя. Поэтому тщательное изучение возможных процессов коррозии и разработка способов предупреждения коррозии – важные задачи строителей.
Цементный камень бетонных сооружений не остается инертным к окружающей его среде – он постепенно подвергается ее действию. Особенно быстро протекают разрушения, если на бетон действуют воды, содержащие растворенные соли, кислоты или другие химические вещества.
Скорость и интенсивность разрушения строительных материалов определяется не только свойствами самого материла, но и силой агрессивностью воздействия на него.
Классификация коррозии бетона В.М. Москвиным:
1 вид – относятся те процессы коррозии, в результате которых растворяются составные части цементного камня;
2 вид – реакции обмена, сопровождающиеся образованием рыхлых, не обладающих вяжущими свойствами продуктов, которые ослабляют структуру цементного камня и в ряде случаев могут быть вынесены затем за счет вымывания;
3 вид – процессы, приводящие к накоплению в порах, трещинах и капиллярах бетона солей, которые в дальнейшем при определенных условиях могут разрушить материал.
Все коррозионные процессы протекают в направлении образования веществ, более стойких в данных условиях по сравнению с исходными, и развиваются самопроизвольно.
Рассмотрим пример, действия воды на бетонную плотину. Вода с напорной стороны под давлением проникает в тело бетона. Медленно продвигаясь в его порах, она растворяет гидроокиси кальция (Ca(OH)2) и его насыщенный раствор выступает в виде потеков на открытой поверхности плотины. Здесь вода частично испаряется, а Ca(OH)2 подвергается воздействию углекислоты воздуха, что приводит к образованию труднорастворимого СаСО3. Возникают белые налеты и сталактиты, имеющие тот же состав, что и сталактиты в пещерах.
В результате вымывания Ca(OH)2 бетон постепенно ослабевает и разрушается. Обычно этот процесс контролируется скоростью диффузии растворенной гидроокиси кальция в порах бетона. При медленной фильтрации, скорость испарения воды будет больше скорости поступления воды, тогда в глубине бетона гидроксид кальций Ca(OH)2 станет пересыщенным и он выпадет в осадок, уплотняя тем самым бетон. Дальнейшее действие углекислоты воздуха приведет к еще большему уплотнению бетона. Процесс можно выразить реакцией:
Са(ОН)2 + СО2 → СаСО3 + Н2О
Значительно более опасны для бетона воды, содержащие химически активные вещества. Коррозия такого рода встречается намного чаще. При этом цементный камень, имеющий щелочной характер, будет особенно активно реагировать с кислотами или кислыми солями.
Даже такая слабая кислота, как угольная, диссоциирует в воде на воду и углекислый газ и соединяется с Ca(OH)2, содержащийся в цементном камне, при этом образуя СаСО3. Более сильные кислоты разрушают цементный камень еще интенсивней.
В природных условиях кроме угольной кислоты можно встретить только слабые органические гуминовые кислоты, в очень редких случаях – свободную серную кислоту. В промышленных же сооружениях в контакте с бетоном могут быть молочная, уксусная, щавелевая кислота, например в силосных сооружениях, пищевых комбинатах, а также серная, соляная и азотная, в частности на предприятиях нефтехимии. Коррозионное действие кислот тем сильнее, чем более растворимы их кальциевые соли. Поэтому, например, сравнительно слабая уксусная кислота относится к сильно агрессивным по отношению к бетону. Если в результате реакции образуются недиссоциированные или малодиссоциированные соединения, то коррозионный процесс будет идти до конца в сторону образования таких соединений. Если же в результате реакции образуются растворимые вещества, установится подвижное равновесие. Однако в бетоне, процессы осложняются возможностью образования более сложных соединений. Например, при действии NaCl на бетон Cl- - ион будет связываться гидроалюминатами кальция и образовывать гидрохлоралюминаты кальция согласно реакции:
3CaO∙Al2O3∙6H2O + CaCl2∙4H2O → 3CaO∙Al2O3∙CaCl2∙10H2O
Образование на основе трехкальциевого алюмината двойных солей играет важную роль не только при твердении цемента в присутствии добавок, но и при разрушении цементного камня в бетоне.
Особый вид коррозии возникает при действии на бетон природных вод, содержащих сульфаты (сульфатная коррозия).
В бетоне сооружений, находящихся под действием агрессивных вод, содержащих сульфаты – CaSO4, Na2SO4, MgSO4 и др., разрушение проявляется в виде разбухания и искривления конструктивных элементов. В этом случае, в результате химических реакций между цементным камнем и веществами из внешней среды, образуются новые соединения, объем которых превышает объем твердой фазы компонентов цементного камня. Такой вид коррозии называется коррозией кристаллизации.
Типичный пример, образование «цементной бациллы» - гидросульфоалюмината кальция. Когда растворы, содержащие сернокислые соли, соприкасаются с затвердевшим цементным камнем и проникают внутрь по капиллярным порам внутрь, взаимодействие их с алюминатными минералами цемента приводит к образованию гидросульфоалюминатов кальция, занимающих в два с половиной раза больший объем, чем исходный алюминат кальция. В результате появляются внутренние напряжения, которые могут превысить предел прочности бетона при растяжении и тем самым вызвать появление трещин. Такой процесс возможен, например, при нанесении гипсовой штукатурки на бетонные поверхности. В зоне контакта при увлажнении гипс растворяется и проникает внутрь бетона с образованием гидросульфоалюмината кальция.
Действие сульфатов чаще всего проявляется в морских сооружениях, а также при действии грунтовых вод. Концентрация сульфатов в морской воде весьма велика. Следовательно, основным процессом при действии морской воды на бетон является действие сернокислого магния на гидрат окиси кальция (магнезиальная коррозия):
MgSO4 + Ca(OH)2 + 2H2O → Mg(OH)2 + CaSO4∙2H2O
В продуктах реакции – гидроксид магния и гипс, который может в определенных условиях кристаллизоваться в виде двуводного сернокислого кальция CaSO4 ∙2Н2О и способствовать разрушению бетона.
Повышение стойкости бетона к магнезиальной коррозии может быть достигнуто уменьшением содержания в цементном камне минералов, способных к химическому взаимодействию с внешней средой:
- например, значительно снизить алюминийсодержащего минерала, т.к. он наиболее активен. На этом и основано приготовление сульфатостойкого портландцемента, содержание в нем трехкальциевого алюмината не должно превышать 5%.;
- повышение стойкости достигается также и уменьшением содержания в цементном камне свободного Са(ОН)2.
Серьезную опасность для долговечности конструкций из железобетона представляют сернистые соединения, например сернистый ангидрид SO2. Сернистый ангидрид, растворяясь в воде, превращается в сернистую кислоту, которая взаимодействует с гидроксидом кальция с образованием сернистокислого кальция CaSO3. При этом возможно постепенное окисление сернистой кислоты до серной и образование гипса, что приводит к разрушению бетона вследствие увеличения объема твердой фазы.
На бетон разрушающе действовать может и обычный воздух. Азот, кислород, инертные газы, входящие в состав воздуха, практически не действуют на цементный камень в бетоне. Лишь углекислый газ воздействует на бетон:
Са(ОН)2 + СО2 → СаСО3 + Н2О
Углекислота действует прежде всего на поверхностный слой плотного бетона и постепенно нейтрализует Са(ОН)2 гидроксид кальция во все более глубоких слоях. При этом происходит некоторое уплотнение бетона, что положительно сказывается на стойкости бетонной конструкции. Современные плотные бетоны подвергаются очень медленной карбонизации. Тем не менее, если карбонизация захватит весь защитный слой бетона и распространится до арматуры, бетон потеряет свои защитные свойства по отношении к стали и будет возможна коррозия арматуры во влажном воздухе.
| <== предыдущая лекция | | | следующая лекция ==> |
| Незначительные осложнения | | | ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ |
Дата добавления: 2016-01-03; просмотров: 2132;
