Ионное произведение воды. Водородный показатель (pH раствора)
Вода — слабый электролит, который незначительно диссоциирует на ионы Н+ и ОН-:
Н2O«Н++ОН-
Константа диссоциации воды:
KD= [H+][OH-]/[H2O] (3)
была вычислена при помощи измерений по электрической проводимости: KD=1,810-16. Такое значение KD указывает на крайне незначительную диссоциацию воды. Следовательно, концентрацию воды [Н2О] в знаменателе выражения (3) можно считать величиной постоянной и равной
[Н2O]=(1000 г/л)/(18г/моль) =5,56 моль/л и
[Н2О]•KD=55,56•1,8•10-16=l0-14
Величина KW=KD•[Н2О]=10-14 называется ионным произведением воды и является константой как для чистой воды, так и для разбавленных растворов. Ионное произведение воды увеличивается при повышении температуры.
Можно также записать:
KW=[Н+][ОН-] (4)
Из этого выражения для ионного произведения воды видно, что в чистой воде концентрация гидроксид-ионов и ионов водорода равна:
[Н+]=[ОН-]=ÖKW=Ö10-14 =10-7 моль/л
Если разбавленный раствор содержит больше ионов водорода, чем 10-7 моль/л, то соответственно концентрация гидроксид-ионов уменьшится во столько раз, во сколько увеличилась концентрация ионов Н+. Это следует из уравнения (4).
Концентрация ионов водорода и гидроксид-ионов важна в химии растворов, поэтому была введена специальная величина — водородный показатель, или pH. По определению, водородный показатель есть обратный логарифм концентрации ионов H+:
pH=-lg[H+].
pH чистой воды равен -lg10-7=7. Если в растворе концентрация ионов Н+ больше, чем 10-7 моль/л, то pH такого раствора будет меньше 7, что является показателем кислой среды раствора, Если же [Н+]<10-7 моль/л, то pH>7, и раствор имеет щелочную реакцию.

Для определения среды растворов используются приборы, называемые pH-метрами. Быстрый анализ можно провести, если в исследуемый раствор добавить одну-две капли кислотно-основного индикатора, т.е. такого вещества, которое под действием ионов Н+ и ОН- может резко изменять свою окраску. Изменения окрасок наиболее распространенных индикаторов приведены ниже.

Гидролиз содей
Растворение полярных молекул и ионных соединений в воде сопровождается диссоциацией, Которая является результатом взаимодействия молекул растворителя с растворяемым веществом. При этом в растворе появляются ионы, на которые распалось растворяемое вещество. Все ионы в растворе окружены гидратной оболочкой, т.е. молекулами воды, удерживаемыми около ионов за счет электростатического взаимодействия, так как на ионах сосредоточен значительный электрический заряд, а молекулы воды поляризованы, и поляризация усиливается за счет электрического поля, индуцируемого зарядом иона (так называемая наведенная поляризация). Наиболее сильно эффект дополнительной поляризации проявляется в молекулах из ближайшего к иону слоя гидратной оболочки. Это делает возможным разрыв О—Н связи в молекуле воды и образование новой связи А—ОН или В—Н. Т.е. для электролита АnBm, диссоциирующего на ионы по уравнению: АnВm«nАm++mВn-
возможны реакции между образовавшимися ионами и молекулами воды:
Аm++Н—ОН «А—ОН(m-1)+Н+ (1)
Вn-+Н—ОН«ВН(n-1)-+ОН- (2)
В какую сторону смещено равновесие в реакциях (1) и (2),
зависит от того, насколько сильным будет основание АОН(m-1)+
или кислота ВН(n-1)-. Если, например, АОН(m-1)+ — сильное
основание, а ВН(n-1)— слабая кислота, то равновесие на стадии
(1) смещено влево, а равновесие реакции (2) сдвинуто вправо.
Следовательно, в растворе возникнет некоторое избыточное, по
сравнению с нейтральным раствором, количество ионов ОН-. Таким образом, раствор соли будет иметь щелочную реакцию. Описанный процесс называется гидролизом.
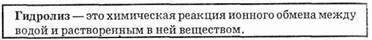
Гидролизу подвергаются не все соли. При растворении, например, хлорида калия продуктами реакций (1) и (2) могут быть лишь КОН (частица АОН(m-1)+) и НСl (частица ВН(n-1)-). Но, как известно, КОН — очень сильное основание, а НС1 — сильная кислота. Поэтому равновесие в реакциях (1) и (2) смещено вправо, и среда раствора будет нейтральной. Следовательно,

Соли, в состав которых входит анион слабой кислоты или катион слабого основания, подвергаются гидролизу. Рассмотрим несколько примеров.
1)Сульфит натрия диссоциирует в воде на ионы Na+ и SO2-3 по уравнению
Na2SO3=2Na++SO2-3
Запишем для них полуреакции (1) и (2): Na++HOH«NaOH+Н+ SO2-3+НОН«HSO-3+ОН-
Гидроксид натрия — очень сильное основание, поэтому первая реакция практически необратимая и идет справа налево. Второе уравнение соответствует процессу, равновесие которого в некоторой степени сдвинуто вправо, так как частица HSO-3 является слабой кислотой (она по определению слабее сернистой кислоты). Следовательно, в растворе образуется избыток гидроксид-ионов, определяющих щелочную среду. Суммарная реакция:
Na2SO3+Н2О«NaHSO3+NaOH

2) Нитрат меди (II) диссоциирует в воде на ионы Cu2+ и NO-3 по уравнению Cu(NO3)2=Cu2++2NO-3
Соответственно Cu2++HOH«CuOH++H+ NO-3+HOH«HNO3+OH-
Взаимодействие нитрат-иона с водой практически не происходит, так как азотная кислота — сильный электролит, практически нацело диссоциированный в водных растворах (равновесие второй полуреакции нацело смещено влево). Напротив, ион CuOH+ достаточно устойчив в данных условиях, так как является основанием, еще более слабым, чем Cu(OH)2. Следователь-I но, равновесие первой полуреакции смещено вправо, и раствор приобретает кислую реакцию. Можно записать суммарную реакцию гидролиза:
Cu(NO3)2+Н2O«[Cu(OH)]NO3+HNO3

3) Если соль образована слабыми основанием и кислотой, то в этом I случае возможен гидролиз как по аниону, так и по катиону. Например, растворение ацетата алюминия (CH3COO)3Al сопровождается следующими реакциями:
СН3СОО-+НОН«СН3СООН+ОН-Аl3++НОН«АlOН2++Н+ АlOН2++НОН«Al(OH)+2+Н+
Характер среды в этом случае определяется относительной I силой образовавшихся кислот и оснований. Среда в этом случае может быть слабокислой, нейтральной или слабощелочной. Иногда, если образующиеся основания и кислоты мало растворимы или летучи, соли гидролизуются нацело: Cr2S3+Н2O=Cr(OH)3+H2S
Повышение температуры увеличивает степень гидролиза. Степень гидролиза, то есть отношение количества гидролизованного вещества к общему количеству растворенного вещества, для солей всех типов, кроме последнего, при комнатной температуре невелика, но при повышении температуры степень гидролиза увеличивается.
Разбавление раствора также увеличивает степень гидролиза (в соответствии с принципом Ле Шателье), поскольку увеличивается концентрация воды.
Дата добавления: 2016-01-03; просмотров: 2197;
