Теория кислот и оснований Льюиса
Существуют, однако, реакции, которые по здравому смыслу должны относиться к кислотно-основным, но на самом деле не подпадают под определение Брёнстеда-Лоури. К ним относятся, например, взаимодействия:
СаО+SO3 ®CaSO4 NH3+BF3®NH3BF3
Для описания реакций подобного типа Г. Льюис (в 1923 г.) предложил новое определение кислот и оснований. Согласно его определению:

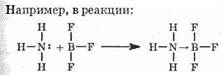
аммиак выступает в роли основания, а трифторид бора в роли кислоты. Определение основания, данное Льюисом, включает основания Брёнстеда-Лоури. Такие кислоты Льюиса, как BF3 и SO3, не являются кислотами Брёнстеда-Лоури, а такие кислоты, как НС1, H2SO4 и СН3СООН, не являются кислотами Льюиса.
Теория кислот и оснований Брёнстеда-Лоури позволяет количественно определять их силу, что нельзя сказать о теории Льюиса. Следует остановиться на электронной теории кислот и оснований, предложенной Г. Льюисом. Как было отмечено выше, согласно этой теории основанием является вещество, поставляющее пару электронов для образования химической связи, а кислотой — вещество, принимающее электронную пару (см. выше).
Определение Г. Льюиса включает кислоты и те соединения, которые не содержат протонов, но удовлетворяют тем критериям, которые он сформулировал для характеристики кислот и оснований:
1. Взаимодействие кислот с основаниями происходит быстро.
2. Кислота или основание вытесняют более слабую кислоту или основание из соединений.
3. Кислоты и основания можно титровать одно другим в присутствии индикаторов.
4. Кислоты и основания являются хорошими катализаторами химических реакций.
Примером кислотно-основного взаимодействия будут (по протонной теории):
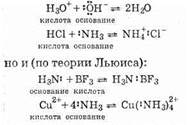
Как видно из этих примеров, в некоторых случаях характеристики вещества по теории Льюиса и по протонной теории кислот и оснований совпадают (NH3 и ОН- — основания, Н3О+ , НСl — кислоты). Вещества же, которые являются кислотами или основаниями только по теории Льюиса, называются основаниями и кислотами Льюиса. Итак, BF3 — кислота Льюиса.
Дата добавления: 2016-01-03; просмотров: 1898;
