Идентификация инфицированных женщин
Так как первичная токсоплазменная инфекция обычно является бессимптомной (Ho-Yen, 1992a), инфицированные женщины могут быть выявлены только с помощью серологических тестов. Обе используемые стратегии (Raeber et al., 1995) рекомендуют проведение первого тестирования всех женщин во время их первого пренатального визита. В соответствии с первой стратегией женщины с отрицательными результатами на антитела к T.gondii тестируются повторно с интервалами на протяжении всей беременности и один раз после родов. Сероконверсия (смена отрицательных на положительные специфические антитела к токсоплазме IgG и/или IgM) указывает на инфицирование во время беременности. Во Франции распространённость перенесённой инфекции высока (54%) (Ancelle et al., 1996), и менее половины женщинам требуется повторное тестирование во время беременности. С другой стороны, в Великобритании (Allain et al., 1998) и Норвегии (Jenum et al., 1998a) только 10% являются ранее инфицированными и 90% женщин необходимо повторное тестирование во время беременности. Материальные затраты повторного тестирования чётко зависят от распространённости токсоплазменной инфекции. Распространённость колеблется в зависимости от страны и этнической группы (таблица 15.1) и снижается с широтой и высотой (Ancelle et al., 1996; Gilbert et al., 1993; Guimaraes et al., 1993; Jeannel et al., 1988; Ljungstrom et al., 1995; Remington et al., 1995; Zuber et al., 1995). (Ades & Nokes, 1993; Bornand & Piquet, 1991; Horion et al., 1990; Nokes et al., 1993).
Во Франции (Thulliez, 1992) и Швейцарии (Raeber et al., 1995) восприимчивые беременные женщины тестируются повторно ежемесячно, а в Австрии, Германии (Raeber et al., 1995) и Италии (Buffolano et al., 1994) три раза в месяц. Ежемесячное тестирование имеет преимущества для раннего лечения, которое, вероятно, снижает риск инфицирования и повреждения плода. Однако, более частое тестирование связано с недостатками снижения частоты детекции с каждым дополнительным тестом, что повышает количество ложноположительных результатов, пренатальных визитов материальные затраты (Anon, 1990). Например, во Франции частота подтверждённой инфекции составляет 8/1000 восприимчивых беременных женщин (Ancelle et al., 1996). В любой срок каждого месяца частота составляет 0.83/1000. Среди восприимчивых беременных женщин ежемесячное тестирования с помощью теста, обладающего 98% специфичностью, 20/1000 женщин будут ложноположительными, а 0.8/1000 действительно положительными. Относительный процент ложноположительных тестов выше в регионах с низкой частотой заболевания. Проведение нескольких тестов одновременно и повторное тестирование снижает частоту ложноположительных результатов, но с материальными затратами. Менее частое тестирование балансирует между ценой определения ложноположительных результатов и возможным вредом запоздалого лечения.
Вторая стратегия основывается на интерпретации тестов инфекции в данный момент среди женщин, которые являются IgG положительными во время первого пренатального визита, с оценкой риска возможного инфицирования после зачатия. Многие центры используют одновременное тестирование на специфические T.gondii антитела IgG и IgM (Aspock & Pollack, 1992; Hengst, 1992; Thulliez, 1992). Специфические IgM в отсутствие IgG указывают на инфицирование в течение последних 2 недель, но требуют подтверждения, так как довольно часты ложноположительные результаты. Если и IgM и IgG являются положительными, необходимо дальнейшее тестирование на высокий или возрастающий титр IgG, низкий афинитет IgG, антитела IgA или комбинация перечисленных тестов, хотя ни один из них не способен отличить, произошло инфицирование до или после оплодотворения. Наиболее многообещающим тестом настоящей инфекции является афинитет IgG (IgG avidity test) (Jenum et al., 1997; Lappalainen et al., 1993), обладающий средней специфичностью по отношению к инфицированию в течение последнего года. Использование этого теста для определения существующей инфекции неизбежно ведёт к бесполезному лечению или прерыванию беременности (Buffolano et al., 1994) у большого количества женщин, инфицированных до зачатия. Среди таких женщин риск инфекции плода незначителен и ограничивается несколькими случаями, описанными в литературе всего мира (Desmonts et al., 1990; Marty et al., 1991; Pons et al., 1995).
Трансмиссия от матери ребёнку и пренатальное лечение
Риск врождённого токсоплазмоза повышается со сроком беременности, в котором произошло инфицирование (Desnond & Couvreur). Недавно проведённое исследование (Dunn et al., 1999) во Франции с участием серо-отрицательных женщин, тестирование которых проводилось ежемесячно, представляет точные данные о риске врождённого токсоплазмоза в зависимости от срока беременности, во время которого впервые замечена сероконверсия. В общем, риск врождённого токсоплазмоза составляет 29%, но маскирует значительное его увеличение со сроком беременности (график 15.1). Риск низок в ранние сроки беременности и составляет только 6% (3-9%) на 13 неделе беременности. Далее риск резко повышается, достигая 40% (34-46%) на 26 неделе, 72% (61-80%) на 36 неделе беременности и 81% перед родами.
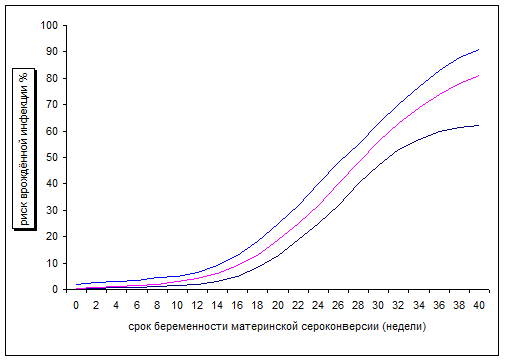
График 15.1 Риск врожденной инфекции в зависимости от срока беременности, в который происходит сероконверсия. Линии представляют 90% доверительный интервал.
Диагностика врождённой инфекции основывается на персистенции специфических антител IgG в сыворотке после 12 месяца жизни, идентифицировании паразита в амниотических водах или продуктах плода при обнаружении ДНК T.gondii с помощью ПЦР или выделении паразита при заражении мыши (Lebech et al., 1996). Ложноположительные результаты ПЦР имеют место и зависят от точности техники (Guy et al., 1996). Установленная чувствительность ПЦР составляет примерно 90-97% (Hohlfeld et al., 1994; Jenum et al., 1998b). Во Франции амниоцентез откладывают на 4 неделю после установления материнской инфекции (Dunn et al., 1999). Рациональность заключается в выжидании времени, когда трансмиссия является завершённой, но доказательства этого недостаточны.
При рождении ребёнка врождённая инфекция может быть исключена при исчезновении IgG в детском возрасте, но только после окончания лечения. Это связано с тем, что лечение против токсоплазмоза подавляет продуцирование антител до неопределяемого уровня. У инфицированных детей продукция антител вскоре возрастает после прекращения лечения (Fortier et al., 1997).
Курс лечения предотвращения трансмиссии от матери ребёнку обычно состоит из спирамицина (9х106ед/д), который назначается сразу после подтверждения материнской инфекции. В некоторых центрах Франции женщинам, инфицированным после 32 недели беременности, назначают более сильно действующий режим: пириметамин (50 мг/д) и сульфадиазин (3 г/д) плюс добавление фолиевой кислоты 3 раза в неделю со спирамицином (Dunn et al., 1999). Рациональность последнего режима заключается в снижении риска повреждения плода при высоком риске инфекции плода (свыше 50%). Пириметамин и сульфадиазин проникают в плод в больших концентрациях, нежели спирамицин, и в отличие от спирамицина проникают в мозг и спинномозговую жидкость (Schoondermark van de Ven et al., 1994, 1995). К побочным эффектам спирамицина относятся: тошнота, рвота, боли живота, сухость во рту и реже кожная сыпь. Пириметамин и сульфадиазин связаны с депрессией костного мозга, сыпью, рвотой, респираторным дистрессом, тахикардией и судорогами. Пириметамин обладает тератогенным свойством у крыс в дозах, схожих с дозами, применяемыми для человека, но этот эффект сглаживается при назначении фолиевой кислоты. Этот препарат можно назначать только во второй половине беременности (Remington et al., 1995).
Доказательства эффективности любого режима пренатального лечения по отношению к снижению трансмиссии от матери ребёнку недостаточны. По данным двух систематических обзоров не обнаружено контролируемых исследований (Eskild et al., 1996; Wallon et al., 1999), и ни в одном из наблюдательных исследований не обращено внимание на скачок риска трансмиссии материнской инфекции с возрастанием срока беременности (Dunn et al., 1999). Однако, недавно проведённое исследование (Foulon et al., 1999) не обнаружило ни одного эффективного воздействия пренатального лечения на частоту трансмиссии в соответствии со сроком беременности во время инфицирования. Одним из объяснений является тот факт, что лечение назначалось после осуществления трансмиссии от матери плоду. По данным опытов на животных, в большинстве случаев трансмиссия происходит в фазе паразитемии, которая продолжается 2-3 недели после инфицирования (Remington et al., 1995).
Во многих центрах лечение продолжается в течение беременности из-за теоретического риска замедленной трансмиссии. Это мнение является противоречивым. Доказательство замедленной трансмиссии основывается на малом количестве исследований ложноотрицательных анализов ПЦР проб амниотических вод плода, хотя в дальнейшем было доказано инфицирование этих детей. Однако, такие результаты могут быть следствием нечувствительности теста или возможности амниоцентеза быть причиной трансмиссии от матери к ребенку, как в случае ВИЧ инфекции.
Дата добавления: 2015-11-28; просмотров: 654;
