Синтез коллоидных КТ в неполярных средах
Метод роста коллоидных квантовых точек в неполярных средах обладает рядом несомненных преимуществ:
1. возможность контроля процесса роста квантовых точек
2. хорошая пассивация поверхностных состояний квантовых точек
3. узкое распределение по размерам (на уровне 5-8 %)
4. возможность последующего выделения и очистки квантовых точек (отсутствие матрицы)
Разработанные на данный момент разновидности данного метода включают синтез в координирующем растворителе и синтез с координирующим прекурсором:
· Синтез в высококипящем стабилизирующем растворителе (например, триоктилфосфин оксид). Прекурсоры - диметилкадмий и триоктилфосфин халькогенид.
· Синтез в высококипящем инертном растворителе (некоординирующий растворитель – например, дифениловый эфир) с использованием стабилизирующих прекурсоров (например, олеата кадмия).
В коллоидном синтезе можно выделить 3 основные стадии:
1) Нуклеация;
2) Рост зародышей;
3) Стадия созревания Освальда;
Стадия нуклеации в пересыщенном растворе.
Согласно классической теории зародышеобразования, нуклеация происходит спонтанно: в некоторых нестабильных участках пересыщенного раствора молекулы или ионы растворённого вещества сами по себе способны кристаллизоваться, образуя зародыши (рис. 14). Гомогенная нуклеация обусловлена термодинамически, поскольку пересыщенный раствор нестабилен по энергии. Cкорость образования зародышей пропорциональна относительному пересыщению и может быть выражена уравнением:
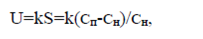
где k- коэффициент пропорциональности, S- степень пересыщения, Сн- концентрация
насыщенного раствора, Сп- концентрация пересыщенного раствора.
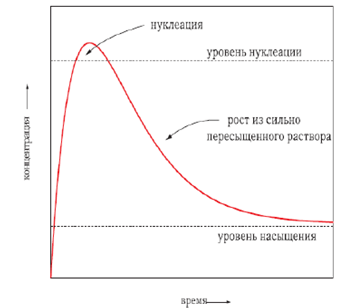
Рис. 14. Изменение концентрации конденсирующегося вещества на этапах нуклеации
и роста из сильно пересыщенного раствора.
Чем больше разность Сп-Сн и чем меньше Сн, тем быстрее образуются зародыши, тем больше возникает центров кристаллизации и тем ближе по размеру оказываются коллоидные частицы к некоторому среднему значению. При образовании зародышей появляется новая поверхность раздела фаз. Этот процесс увеличивает свободную энергию системы пропорционально квадрату диаметра частиц. В то же время происходит снижение энергии системы за счет химического превращения, пропорциональное диаметру кристаллитов в степени 3.
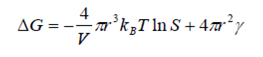
где V – молекулярный объем осаждаемой фазы, r – радиус зародыша, kB – постоянная
Больцмана, γ – удельная поверхностная энергия.
Таким образом, зависимость суммарного изменения свободной энергии системы от
размера частиц имеет экстремум при критическом размере r* (рис.15):
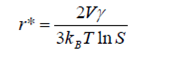
Максимальная свободная энергия равна энергии активации зародышеобразования. Для данного значения S все частицы с размером большим r* будут расти, а все частицы с размером меньше r* будут растворяться. Как видно из приведенного уравнения бóльшая
степень пересыщения соответствует меньшему критическому размеру зародышей.
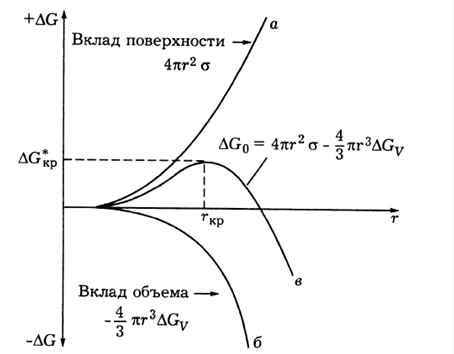
Рис. 15. Схема формирования барьера нуклеации: а) увеличение свободной энергии из-за роста межфазовой поверхности, б) снижение свободной энергии из-за фазового превращения, в) результирующее изменение ∆G.
Стадия роста зародышей.
Коллоидная теория при интерпретации явлений, связанных с ростом кристаллов, исходит из связи между формой кристалла и поверхностной энергией всех его граней. Согласно диффузионной трактовке роста кристаллов, процесс образования кристаллической грани протекает с большой скоростью и зависит только от скорости диффузии. Поскольку процесс является диффузионным, основным параметром для его регулирования является температура. Если предположить, что процесс роста грани является более медленным, чем процесс подвода вещества, изменение концентрации вещества имеет вид
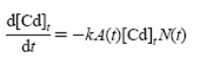
Тогда рост нанокристаллов сферической формы может быть описан следующим выражением
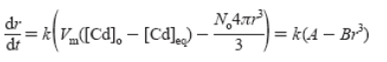
На рисунке 16 показана кинетика роста наночастиц CdSe (экспериментальные данные) и аппроксимация выражением для роста сферических наночастиц)
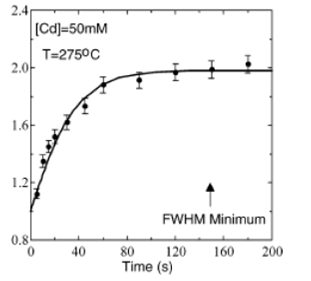
Рис.16 Зависимость размера нанокристаллов CdSe от времени роста.
Созревание Освальда
Когда реагенты исчерпаны из-за роста частиц начинается процесс созревания Оствальда, при котором большие частицы продолжают расти за счёт растворения более мелких, уменьшая поверхностную энергию системы. При этом происходит дефокусировка. При уменьшении степени пересыщения критический размер зародышей растет и частицы меньше этого критического размера растворяются. Если реакцию быстро остановить на этой стадии частицы будут иметь широкое распределение по размерам. На этапе созревания Оствальда невозможно получить монодисперсные частицы. Размер оставшихся после полного исчезновения пересыщения частиц может достигать микрометров, поэтому нанокристаллы с хорошим распределением по размерам можно получить лишь при взрывной нуклеации и остановке реакции быстро после ее окончания и до начала созревания Оствальда. Для взрывной нуклеации необходимо создавать высокую степень пересыщения.
Стабилизация частиц.
Отдельного внимания заслуживает вопрос стабилизации золя. Нам необходимо достичь не только заданной дисперсности, но и стабилизировать раствор во времени. Этого можно добиться за счет уменьшения энергии поверхностного натяжения на границе раздела фаз, что ведет к присутствию в системе кроме дисперсионной среды и дисперсной фазы еще одного компонента – стабилизатора дисперсной системы. Адсорбируясь на границе раздела фаз, он создает структурно-механический барьер и таким образом препятствует агрегации. Именно удачный выбор стабилизатора имеет решающее значение в коллоидном синтезе КТ. Требования к стабилизатору предъявляются довольно высокие:
во-первых, он должен предотвращать агрегацию частиц дисперсной фазы. Во-вторых, не
препятствовать диффузионному росту КТ. В-третьих, ориентируясь на поверхности коллоидной частицы, молекулы стабилизатора должны быть крепко с ней связаны ковалентной связью с одной стороны, в то время как свободный конец молекулы должен
иметь сильное сродство к растворителю, то есть к дисперсионной среде, обеспечивая тем
самым достаточно высокую ”растворимость” КТ. А в-четвертых, молекулы стабилизатора
должны пассивировать поверхность КТ, устраняя оборванные связи и локализуя внутри нее носители заряда.
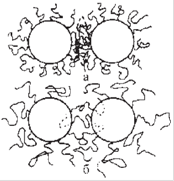
Рис. 17. Механизмы, противодействующие сближению коллоидных частиц за счёт
локального увеличения концентрации (а) и за счёт механического отталкивания.
Силы, противодействующие агрегации нанокристаллов, можно проиллюстрировать следующим образом. При достаточном сближении коллоидных частиц, покрытых стабилизирующим веществом (СВ), происходит перекрытие защитных слоев сближающихся частиц, которое можно рассматривать как локальное увеличение концентрации СВ, а это, в случае высокого сродства алкильных окончаний молекул СВ к молекулам дисперсионной среды, ведет к увеличению свободной энергии системы.
Основные типы стабилизаторов
При образовании нанокристаллов халькогенидов кадмия на поверхности оказываются непассивированные связи Cd (свободная p-орбиталь) и халькогена (свободная электронная пара), вследствие чего будут гаситься заряды, что значительно ухудшит люминесцентные свойства. Поэтому необходимо вещество, способное устранить такие связи. Во-первых, необходимо стабилизировать связи Cd, который является акцептором электронной пары, то есть необходим донор электронов. В этом случае возможно использование молекул триоктилфосфиноксида. На атоме фосфора имеется неподеленная электронная пара, которая необходима для стабилизации связи у Cd. Во-вторых, у него должны быть длинноцепочечные радикалы, во избежание агломерации (слипания частиц). Поэтому и
используется хвост углеводородного радикала (октил), который помимо своей основной
функции обеспечивает хорошую растворимость в неполярных (органических) соединениях. Возможными органическими стабилизаторами могут выступать любые нуклеофильные реагенты (должны содержать в себе металлкоординирующую группу, которая обычно является донором электронов электрон-дефицитным атомам) с длинноцепочечными радикалами. Например, такие как: амины, тиолы, карбоновые кислоты (высшие кислоты). Остановимся подробнее на каждом классе.
1) Амины. Свойства аминов зависят от степени замещенности при атоме азота. Первичные и вторичные амины могут образовать как электродонорную (с Cd), так и протонодонорную связь (с Te). Благодаря таким свойствам они могут использоваться в качестве стабилизатора. Немаловажную роль играет и тот факт, что свойства нуклеофила у алифатических аминов проявляются сильнее, нежели у ароматических, это дает возможность вводить длинные углеводородные радикалы.
2) Тиоспирты (тиолы) – аналоги обычных спиртов, в молекулах которых вместо кислородного атома содержится атом серы. Тиоспирты плохо растворяются в воде, но хорошо – во многих органических растворителях.
3) Наиболее перспективными стабилизаторами выступает класс карбоновых кислот, а точнее ряд длинноцепочечных (жирных) кислот. Атомом, осуществляющим стабилизацию, выступает кислород в гидроксильной группе. Наиболее значимый эффект оказывают жирные кислоты, в связи с наличием длинноцепочечного углеводородного радикала, который в большей мере препятствует агломерации частиц. Одним из лучших стабилизаторов этого класса является олеиновая кислота.
Анионные стабилизаторы.
ü Фосфинхалькогениды, например триоктилфосфинхалькогениды ТОР-S, ТОР-Se,
ТОР-Te. Наиболее распространенный тип анионной стабилизации. Относительно прочная связь между атомом фосфора и халькогеном (поверхностный атом) позволяет пассивировать оборванные связи на атоме халькогена, которые являются ловушками для фотовозбужденных дырок. Как правило, пассивация достигается введением фосфинов в ростовую среду. Возможно использовать трибутилфосфин халькогениды.
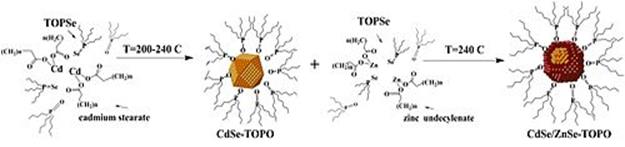 Схема синтеза CdSe-ZnSe квантовых точек (ядро-оболочка)
Схема синтеза CdSe-ZnSe квантовых точек (ядро-оболочка)
(ТОРО -Trioctylphosphine oxide)
Дата добавления: 2015-12-22; просмотров: 1239;
