Составление уравнений ОВР
Для составления уравнений ОВР применяют различные методы, например, для реакций, происходящих в водных растворах (в этой работе рассмотрены в основном такие), - метод электронно-ионных полуреакций. При использовании этого метода необходимо:
· применять правила написания ионных уравнений;
· соблюдать материальный баланс (число атомов химического элемента в левой и правой частях уравнений должно быть одинаковым);
· соблюдать баланс электронов (число электронов, отданных восстано-вителем и принятых окислителем должно быть одинаковым).
При составлении уравнений полуреакций окисления и восстановления необходимо учитывать среду и возможность участия в реакции молекул воды или других ионов. Для уравнивания числа атомов кислорода (наиболее часто встречающийся случай) можно воспользоваться табл. 3, в которой «избыточный» атом кислорода в составе сложной частицы обозначен «O2— »:
Таблица 3
| Процесс | Среда в окислительно – восстановительных реакциях | ||
| кислая | щелочная | нейтральная | |
| Связывание «O2–»: (NO3—® NO2—) | «O2—»:+ 2H+ = H2O | «O2—»: + H2O = 2OH— | «O2—» + H2O =2OH— |
| Введение «O2—» (SO32— ® SO42—) | H2O = «O2—»:+ 2H+ | 2OH— = «O2—» + H2O | H2O = «O2—» + 2H+ |
Алгоритм расчета коэффициентов и написания ОВР рассмотрим на примере составления уравнения реакции с заданными в ионной форме продуктами. Схема ОВР:



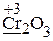 +
+ 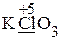 + KOH ®
+ KOH ® 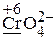 + Cl—
+ Cl—
Ох Red
· Рассчитываем степени окисления элементов (указаны на схеме), определяем окислитель и его восстановленную форму (СlO3— ® Cl—), восстановитель и его окисленную форму (Cr2O3 ® CrO42—).
· Делим реакцию на две полуреакции – полуреакцию окисления и полуреакцию восстановления, т.е. записываем отдельно выделенные пары. Уравниваем в левой и правой частях каждой полуреакции число атомов элемента, отличающегося от кислорода и водорода (Cr):
Cr2O3 ® 2CrO42—
ClO3— ® Cl —
· При необходимости уравниваем число атомов кислорода (табл.3) и водорода с учётом того, что задана щелочная среда (в исходных веществах присутствует щёлочь КОН):
Cr2O3 + 10OH— ® 2CrO42— + 5H2O
ClO3— + 3H2O ® Cl— + 2OH—
· По изменению степени окисления атомов элементов подсчитываем число отданных и принятых электронов и дописываем их со знаком (+) или (-) в левую часть уравнений полуреакций:
Cr2O3 - 6ē + 10OH— ® 2CrO42— + 5H2O
ClO3— + 6ē + 3H2O ® Cl— + 6OH—
· Проверяем равенство суммарного заряда ионов и электронов в левой и правой частях уравнений полуреакции:
• первая полуреакция (окисления)
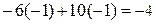
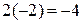 ;
;
слева справа
• вторая полуреакция (восстановления)
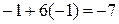
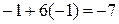
слева справа
Затем уравниваем число отданных и принятых электронов (ставим наименьшие кратные множители перед уравнениями полуреакций), суммируем уравнения, умножив каждое слагаемое на соответствующий коэффициент:
 1 Cr2O3 - 6ē + 10(OH)- = 2CrO42— + 5H2O
1 Cr2O3 - 6ē + 10(OH)- = 2CrO42— + 5H2O
 1 ClO3— + 6ē + 3H2O = Cl— + 6OH—
1 ClO3— + 6ē + 3H2O = Cl— + 6OH—
Cr2O3 + ClO3— + 10(OH)— + 3H2O = 2CrO42— + Cl- + 5H2O + 6(OH)—
· Приводим подобные члены в суммарном уравнении и по полученному ионному уравнению, где стоят все основные коэффициенты,



 Cr2O3 + ClO3— + 4(OH)— = 2CrO42—+ Cl— + 2H2O,
Cr2O3 + ClO3— + 4(OH)— = 2CrO42—+ Cl— + 2H2O,
К+ 4К+ 4К+ К+
дописываем молекулярное уравнение:
Cr2O3 + KClO3 + 4KOH = 2K2CrO4 + KCl + 2H2O.
Соблюдая электронейтральность молекул, составляем формулы продуктов реакции подбором для каждого иона противоположно заряженных ионов – противоионов, включая и те, которые не показаны в ионном уравнении (в данной реакции это ионы K+, они указаны под ионным уравнением для каждого из ионов снизу от черты).
Аналогично составляют ОВР в других средах, например в кислой среде:

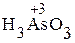 +
+ 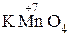 + H2SO4 ®
+ H2SO4 ® 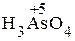 + Mn2+.
+ Mn2+.
5 H3AsO3 - 2ē + H2O = H3AsO4 + 2H+
2 MnO4— + 5ē + 8H+ = Mn2+ + 4H2O
 |
5H3AsO3 + 5H2O + 2MnO4— + 16H+ = 5H3AsO4 + 10H+ + 2Mn2+ + 8H2O

 5H3AsO3 + 2MnO4— + 6H+ = 5H3AsO4 + 2Mn2+ + 3H2O
5H3AsO3 + 2MnO4— + 6H+ = 5H3AsO4 + 2Mn2+ + 3H2O

 2К+ 3SO42— 2SO42— SO42— 2К+
2К+ 3SO42— 2SO42— SO42— 2К+
5H3AsO3 + KMnO4 + H2SO4 = 5H3AsO4 + 2MnSO4 + 3H2O + K2SO4
Дата добавления: 2015-12-16; просмотров: 885;
