Электродные потенциалы. Направление ОВР
В каждой окислительно-восстановительной реакции, в том числе в реакции
Zn + CuSO4 = ZnSO4 + Cu (1)
участвуют две окислительно-восстановительные пары - восстановитель (Zn) и его окисленная форма (Zn2+); окислитель (Cu2+) и его восстановленная форма (Cu). Мерой окислительно-восстановительной способности данной пары является окислительно-восстановительный или электродный потенциал,который обозначают 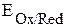 , где Ox – окисленная форма, Red – восстановленная форма (например,
, где Ox – окисленная форма, Red – восстановленная форма (например, 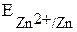 ,
, 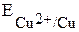 ). Измерить абсолютное значение потенциала невозможно, поэтому измерения осуществляют относительно эталона, например стандартного водородного электрода.
). Измерить абсолютное значение потенциала невозможно, поэтому измерения осуществляют относительно эталона, например стандартного водородного электрода.
Стандартный водородный электрод состоит из платиновой пластинки, покрытой тонким порошком платины, погруженной в раствор серной кислоты с концентрацией ионов водорода, равной 1 моль/л. Электрод омывают током газообразного водорода под давлением 1,013 · 105 Па при температуре 298 К. На поверхности платины протекает обратимая реакция, которую можно представить в виде:
2H+ + 2 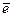 Û H2.
Û H2.
Потенциал такого электрода принимают за нуль: 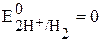 В (размерность потенциала – Вольт).
В (размерность потенциала – Вольт).
Стандартные потенциалы измерены или рассчитаны для большого числа окислительно-восстановительных пар (полуреакций) и приведены в таблицах. Например, 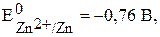
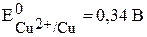 . Чем больше значение
. Чем больше значение 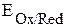 , тем более сильным окислителем является окисленная форма (Оx) данной пары. Чем меньше значение потенциала, тем более сильным восстановителем является восстановленная форма (Red) окислительно-восстановительной пары.
, тем более сильным окислителем является окисленная форма (Оx) данной пары. Чем меньше значение потенциала, тем более сильным восстановителем является восстановленная форма (Red) окислительно-восстановительной пары.
Ряд металлов, расположеных в порядке увеличения их стандартных электродных потенциалов, называют электрохимическим рядом напряжений металлов (рядом активности металлов):
Li Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Bi Cu Ag Hg Au
 E0 < 0 E0=0 E0 > 0
E0 < 0 E0=0 E0 > 0

Начинается ряд наиболее активными металлами (щелочными), а завершается «благородными», т.е. трудноокисляемыми металлами. Чем левее расположены в ряду металлы, тем более сильными восстановительными свойствами они обладают, они могут вытеснять из растворов солей металлы, стоящие правее. Металлы, расположенные до водорода, вытесняют его из растворов кислот (кроме HNO3 и H2SO4 конц).
В тех случаях когда система находится в нестандартных условиях, значе-
ние электродного потенциала можно рассчитать по уравнению Нернста:
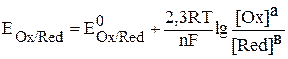 ,
,
где 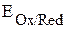 – потенциал системы при нестандартных условиях, В;
– потенциал системы при нестандартных условиях, В;
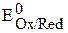 – потенциал системы при стандартных условиях, В;
– потенциал системы при стандартных условиях, В;
R – универсальная газовая постоянная (8,31 Дж/моль•К);
T – температура, К;
n – число электронов, участвующих в процессе;
F – число Фарадея (96500 К/моль);
[Ox]а, [Red]в – произведение концентраций (моль/л) окисленной и восстановленной форм участников процесса, возведенных в степень стехиометрических коэффициентов.
Концентрации твердых веществ и воды принимают за единицу.
При температуре 298 К, после подстановки численных значений R и F,
уравнение Нернста принимает вид:
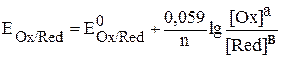 . (2)
. (2)
Так, для полуреакции
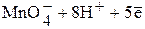 Û
Û 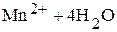
уравнение Нернста
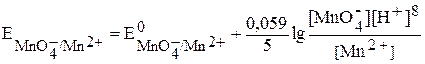 .
.
Используя значения электродных потенциалов, можно определить направление самопроизвольного протекания окислительно-восстановительной реакции. В ходе ОВР электроны всегда перемещаются от пары, содержащей восстановитель, к паре, содержащей окислитель. Обозначим
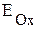 - электродный потенциал пары, содержащей окислитель;
- электродный потенциал пары, содержащей окислитель;
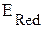 - электродный потенциал пары, содержащей восстановитель.
- электродный потенциал пары, содержащей восстановитель.
Если 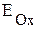 >
> 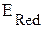 - самопроизвольно может идти прямая реакция;
- самопроизвольно может идти прямая реакция;
Если 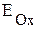 <
< 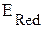 - прямая реакция невозможна, но возможна обратная реакция.
- прямая реакция невозможна, но возможна обратная реакция.
Для рассмотренной ранее (с.24) реакции (1):

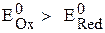 , т.е. реакция в стандартных условиях возможна.
, т.е. реакция в стандартных условиях возможна.
Дата добавления: 2015-12-16; просмотров: 2535;
