Взаимодействие металлов с водой и растворами щелочей
Реакции взаимодействия металлов с водой в общем виде описываются схемой
M + H2O ® M(OH)n + H2.
Red Ox
Полуреакция восстановления катиона водорода в составе воды (окислителя):
2H2O + 2ē = H2 + 2OH-, 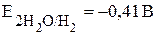 .
.
Следовательно, реагировать с водой могут те металлы, потенциал которых менее -0,41 B. Практически в воде растворяются щелочные и щелочноземельные металлы, а такие металлы, как алюминий, цинк, хром, титан, с водой не реагируют из-за явления пассивации.
В растворах щелочей окислительное действие оказывают также молекулы воды, но с увеличением pH окислительная способность воды уменьшается, при pH = 14 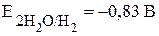 . Другое отличие поведения металлов в растворах щелочей обусловлено растворением пассивирующих плёнок на металлах, оксиды которых амфотерны. В результате алюминий, цинк, олово растворяются в щелочах с образованием водорода и соответствующих солей, к примеру:
. Другое отличие поведения металлов в растворах щелочей обусловлено растворением пассивирующих плёнок на металлах, оксиды которых амфотерны. В результате алюминий, цинк, олово растворяются в щелочах с образованием водорода и соответствующих солей, к примеру:
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2.
При рассмотрении процессов коррозии металлов следует иметь в виду следующее: даже если металл начинает корродировать, это не значит, что он полностью окислится. В тех случаях когда на поверхности металла образуются нерастворимые и беспористые продукты коррозии (оксиды, гидроксиды), процесс тормозится, металл практически не подвергается коррозионному разрушению, происходит пассивация. К примеру, алюминий практически не реагирует с водой из-за образования на его поверхности нерастворимой оксидной плёнки, хотя реакция возможна, исходя из сравнения потенциалов: 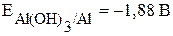 ,
, 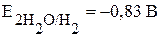 , т.е.
, т.е. 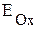 >
> 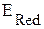 .
.
Когда продукт коррозии растворим в данной среде или механически непрочен, металл практически неустойчив в данных условиях.
Дата добавления: 2015-12-16; просмотров: 1360;
