Методы защиты металлов от коррозии
· Защитные покрытия.Неметаллические: нанесение лаков, красок, эмалей, фосфатирование, оксидирование и т.д. Металлические: их делят на анодные (металл покрытия более активный, чем защищаемый) и катодные (металл покрытия менее активный, чем защищаемый). Например, если поверхность стальной детали покрыта в одном случае слоем цинка, а в другом - слоем никеля, и оба металла находятся в кислой среде, то цинковое покрытие - анодное 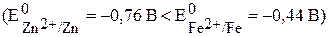 , а никелевое покрытие - катодное
, а никелевое покрытие - катодное 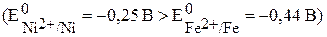 .
.
· Электрохимическая защита. Сущность метода заключается, как правило, в подаче на защищаемый металл избыточного количества электронов. Два способа реализации этого метода - протекторная и катодная защита. При протекторной защите источником электронов является протектор (более активный металл). Например, стальной корабельный корпус соединяют с протектором (цинковой болванкой): цинк разрушается, отдавая электроны на корпус корабля и защищая его от коррозии. При катодной защите электроны на защищаемую конструкцию подают, путем присоединия её к отрицательному электроду (катоду) внешнего источника постоянного тока. Положительный электрод присоединяют к ненужной стальной детали, которая и корродирует.
· Обработка коррозионной среды. Проводится для снижения коррозионной активности среды: нейтрализация, кипячение, дегазация жидкостей, осушение газов, добавление ингибиторов (замедлителей коррозии) и т.д.
ЭЛЕКТРОЛИЗ
Электролиз - сложная совокупность процессов (в основном окислительно-восстановительных), происходящих при прохождении через раствор или расплав электролита электрического тока. При электролизе электрическая энергия расходуется на проведение химических реакций, т.е. это процесс, обратный происходящему в гальваническом элементе.
Электролиз проводят в специальных устройствах - электролизёрах. Простейший электролизёр состоит из ёмкости, в которую помещают электролит, и двух электродов.
· Катодэлектролизёра подключён к отрицательномуполюсу внешнего источника тока, на нём происходит восстановление.
· Анодэлектролизёра подключён к положительномуполюсу источника тока, на нём происходит окисление.
Электроды могут быть активные (расходуемые) и инертные (нерасходуемые). В качестве инертных электродов обычно используют графит и платину.
Катодные процессы. Участниками катодного процесса могут быть:
· катионы металлов
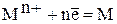 ;
;
· катионы водорода (свободные или в составе молекул воды)
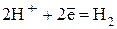 (в кислой среде);
(в кислой среде);
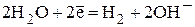 (в нейтральной и щелочной средах).
(в нейтральной и щелочной средах).
В первую очередь восстанавливаются более сильные окислители, т.е. проходит полуреакция с более положительным потенциалом. При наличии тока в цепи потенциалы смещаются от их равновесных значений. Это называется явлением перенапряжения. Для катионов металлов перенапряжение невелико, и можно воспользоваться значениями стандартных электродных потенциалов. Потенциал восстановления катионов водорода из воды с учетом перенапряжения 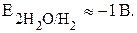
Анодные процессы. Участниками анодного процесса могут быть:
· материал анода 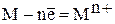 ;
;
· молекулы воды 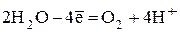 ;
;
· анионы солей, например 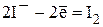 ,
, 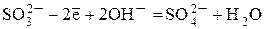 и т.д.
и т.д.
Анионы, включающие элементы в высшей степени окисления, на аноде не окисляются (SO42— , NO3— , CO32—, PO43— и другие).
В первую очередь окисляются более сильные восстановители, т.е. проходит полуреакция с меньшим потенциалом. Для анионов можно воспользоваться значениями стандартных электродных потенциалов. Потенциал выделения кислорода из воды с учетом перенапряжения 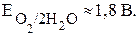
Пример 1. Рассмотреть схему электролиза водного раствора Na2SO4 с инертными электродами. В растворе соль диссоциирует на ионы: Na2SO4 = 2 Na+ + SO42—
При подаче на электроды напряжения происходит направленное перемещение частиц: положительно заряженных ионов Na+ к отрицательному катоду, а отрицательно заряженных ионов SO42- - к положительному аноду.
ē ē
 |  |
(-) катод анод (+)
 |  |  | |||
H2O H2O H2O H2O
Na+
SO42—®
 |
Схема электролиза:
 К (-) А (+)
К (-) А (+)
Na+ , HOH SO42—, HOH
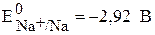 Сульфат-ионы не разряжаются,
Сульфат-ионы не разряжаются,
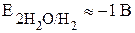 , происходит окисление воды:
, происходит окисление воды:
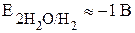 >
> 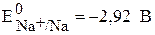 ,
, 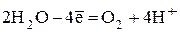 .
.
т.е. происходит восстановление воды: В прианодном пространстве скаплива-
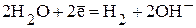 . ются ионы H+, среда становится кислой.
. ются ионы H+, среда становится кислой.
В прикатодном пространстве скапли-
ваются ионы ОН—, среда становится
щелочной.
Пример 2. Рассмотреть схему электролиза водного раствора NiCl2 с инертными электродами и с электродами из никеля.
· Инертные электроды. NiCl2 = Ni2+ + 2Cl—
 К (-) А (+)
К (-) А (+)
Ni2+ , HOH Cl—, HOH
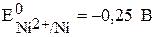
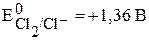
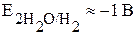
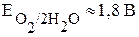
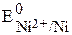 >
> 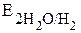 , происходит
, происходит 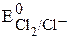 <
< 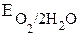 ,
,
восстановление ионов никеля: происходит окисление ионов Cl—:
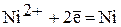
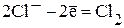
·  Электроды из никеля. К (-) А (+) Ni
Электроды из никеля. К (-) А (+) Ni
Ni2+ , HOH Cl-, HOH, Ni
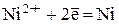
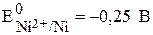 ,
,
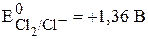 ,
, 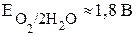 ,
,
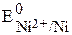 <
< 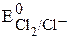 и
и 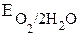
происходит окисление (растворение)
анода: 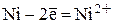 .
.
Количественные соотношения при электролизе определяются в соответствии с законом Фарадея:
· масса веществ, образующихся или растворяющихся при электролизе, пропорциональна количеству электричества, прошедшего через электролит.
При проведении расчётов используют формулу
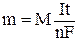 ,
,
где 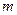 - масса вещества, г;
- масса вещества, г;
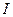 - сила тока, А;
- сила тока, А;
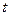 - время, с;
- время, с;
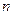 - число электронов, участвующих в электродном процессе;
- число электронов, участвующих в электродном процессе;
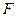 - постоянная Фарадея (96500 Кл/моль).
- постоянная Фарадея (96500 Кл/моль).
Для определения объема газообразных продуктов, выделяющихся при нормальных условиях, необходимо подставлять вместо молярной массы (М) молярный объем газа при нормальных условиях (V=22,4 л/моль).
Пример 3. Рассчитать массу никеля и объём хлора, выделившихся при электролизе раствора хлорида никеля с инертными электродами (см. пример 2) за 1 час при силе тока 2 А.
Решение
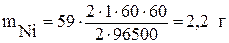 ;
; 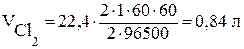 .
.
Дата добавления: 2015-12-16; просмотров: 1194;
