Химические источники тока
Химические источники тока (ХИТ) – это системы для непосредственного превращения химической энергии окислительно-восстановительной реакции в электрическую. В настоящее время существует очень большое число типов ХИТ: гальванические, комбинированные, резервные, топливные элементы, аккумуляторы. Основной отличительной особенностью аккумуляторов является то, что реакции, протекающие в них, являются обратимыми, поэтому их можно заряжать и использовать не один раз. Условное обозначение ХИТ:
(а) / электролит // электролит / (к)
или (а) / электролит / (к) ,
где (а) – материал анода (электрода, на котором идет процесс окисления);
(к) – материал катода (электрода, на котором идет процесс восстановления);
/ – поверхность раздела электролит - раствор или расплав электролита;
// – поверхности раздела пространственно удалены друг от друга. При работе источников тока в них протекают достаточно сложные, многостадийные процессы. Условия, необходимые для получения электрического тока в ХИТ:
· ХИТ должен содержать два электрода с различными потенциалами;
· процессы окисления и восстановления должны быть пространственно разделены;
· внешняя и внутренняя цепи должны быть замкнуты.
Далее будут рассмотрены примеры только гальванических элементов.
Пример 1. Схема гальванического элемента:
Zn / ZnSO4 // H2SO4 / H2 (Pt) .
Слева – цинковый электрод, погружённый в раствор сульфата цинка, справа – стандартный водородный электрод (платиновая пластина в растворе серной кислоты). Условия работы гальванического элемента будем считать стандартными, т.е. потенциал электрода из цинка 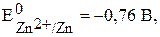 потенциал водородного (платинового) электрода
потенциал водородного (платинового) электрода 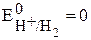 В. Условие самопроизвольного протекания окислительно-восстановительной реакции -
В. Условие самопроизвольного протекания окислительно-восстановительной реакции - 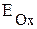 >
> 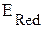 , следовательно, на правом электроде будет идти полуреакция восстановления (платина - катод), а на левом – окисления (цинк - анод):
, следовательно, на правом электроде будет идти полуреакция восстановления (платина - катод), а на левом – окисления (цинк - анод):
· анодный процесс - Zn - 2ē = Zn2+;
· катодный процесс - 2Н+ + 2ē = Н2 .
Ионное и молекулярное уравнения реакции, на которой основана работа гальванического элемента:
Zn + 2Н+ = Zn2+ + Н2 ; Zn + Н2SO4 = ZnSO4 + Н2 .
Электроны, отдаваемые цинком, по внешней цепи перемещаются к катоду, а в противоположном направлении, по внутренней цепи, перемещаются отрицательно заряженные ионы SO42—:
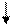

 ē
ē
(-) (+)
(а) Zn / ZnSO4 // H2SO4 / H2 (Pt) (к)

 SO42—
SO42—
 |
ЭДС любого ХИТ рассчитывается как разность 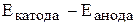 =
= 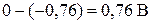 . Значение ЭДС должно быть больше нуля.
. Значение ЭДС должно быть больше нуля.
Пример 2. Схема гальванического элемента:
Al / Al2(SO4)3 0,005M // KСlO3; KCl; H2SO4 / (C)
Слева – алюминиевый электрод, погружённный в раствор сульфата алюминия с концентрацией 0,005 моль/л (при обозначении молярной концентрации обозначение размерности моль/л часто заменяют буквой М), справа – графитовый электрод в растворе двух солей при стандартных условиях. Потенциал алюминиевого электрода необходимо рассчитать по уравнению (2):
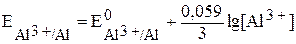 .
.
В условиях указана концентрация соли, ионы алюминия образуются при её диссоциации: Al2(SO4)3 = 2Al3+ + 3SO42—, поэтому [Al3+] = = 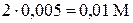 . Таким образом,
. Таким образом,
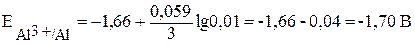 .
.
Потенциал на графитовом электроде равен стандартному потенциалу окислительно-восстановительной пары СlO3—/Cl—: 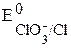 =1,45 В.
=1,45 В.

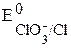 >
> 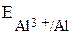 , т.е. в левом полуэлементе находится восстановитель (идёт полуреакция окисления, алюминий – анод), в правом – окислитель (идёт полуреакция восстановления, графитовый электрод – анод).
, т.е. в левом полуэлементе находится восстановитель (идёт полуреакция окисления, алюминий – анод), в правом – окислитель (идёт полуреакция восстановления, графитовый электрод – анод).
Анодный процесс Al - 3ē = Al3+ 2
катодный процесс - СlO3— + 6H+ + 6ē = Cl— + 3H2O 1
Ионное и молекулярное уравнения реакции:
2Al + ClO3— + 6H+ = 2Al3+ + Cl— + 3H2O,
2Al + KClO3 + 3H2SO4 = Al2(SO4)3 + KCl + 3H2O.
Условная схема работы гальванического элемента:
ē
 |
(-) (+)
(а) Al / Al2(SO4)3 // KСlO3; KCl; H2SO4 / (C) (к)
 SO42—
SO42—
 |
ЭДС = 1,45 – (-1,70) = 3,15 В.
КОРРОЗИЯ МЕТАЛЛОВ
Коррозия - процесс самопроизвольного нежелательного разрушения металлов при взаимодействии с компонентами окружающей среды, выполняющими роль окислителей. В литературе по коррозии окислители принято называть деполяризаторами. Процессы коррозии сложные, очень часто многостадийные. В пределах данного курса они будут рассмотрены в упрощенной форме.
Рассмотрим реакции окисления металлов при взаимодействии их с растворами кислот, щелочей и водой. Для решения вопроса о возможности окисления металла необходимо сравнить потенциалы окислителя (Ox) и металла (Red) в рассматриваемой среде. Электродные потенциалы некоторых металлов, а также водорода и кислорода в кислой, нейтральной и щелочной среде приведены в табл. 4. Таблица 4
| Среда | |||||
| кислая (рН=0) | нейтральная (рН=7) | щелочная (рН=14) | |||
| Red/Ox пара | Е0, В | Red/Ox пара | Е, В | Red/Ox пара | Е0, В |
| 2H+/H2 | 0,00 | 2H2O/H2 | - 0,41 | 2H2O/H2 | - 0,83 |
| O2/2H2O | + 1,22 | O2/4OH- | + 0,81 | O2/4OH- | + 0,40 |
| Mg2+/Mg | - 2,36 | Mg(OH)2/Mg | - 2,38 | Mg(OH)2/Mg | - 2,69 |
| Al3+/Al | - 1,66 | Al(OH)3/Al | - 1,88 | AlO2-/Al | - 2,36 |
| Zn2+/Zn | - 0,76 | Zn(OH)2/Zn | - 0,81 | ZnO22-/Zn | - 1,22 |
| Cr3+/Cr | - 0,74 | Cr(OH)3/Cr | - 0,93 | CrO2-/Cr | - 1,32 |
| Fe2+/Fe | - 0,44 | Fe(OH)2/Fe | - 0,46 | Fe(OH)2/Fe | - 0,87 |
| Cd2+/Cd | - 0,40 | Cd(OH)2/Cd | - 0,41 | Cd(OH)2/Cd | - 0,82 |
| Ni2+/Ni | - 0,25 | Ni(OH)2/Ni | - 0,30 | Ni(OH)2/Ni | - 0,72 |
| Sn2+/Sn | - 0,14 | Sn(OH)2/Sn | - 0,50 | SnO22-/Sn | - 0,91 |
| Cu2+/Cu | +0,34 | Cu(OH)2/Cu | + 0,19 | Cu(OH)2/Cu | - 0,22 |
Если выполняется условие самопроизвольного протекания окислительно-восстановительной реакции, т.е. 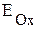 >
> 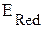 , то процесс коррозии может начаться самопроизвольно. Написание уравнений будем выполнять по правилам составления уравнений ОВР (см. подраздел 6.2).
, то процесс коррозии может начаться самопроизвольно. Написание уравнений будем выполнять по правилам составления уравнений ОВР (см. подраздел 6.2).
Дата добавления: 2015-12-16; просмотров: 856;
