Склад газового середовища 3 страница
Величина граничного струму може бути істотно підвищена інтенсивним перемішуванням розчинів, аерацією, введенням в електроліт окисників, які легко відновлюються на катоді (Н2О2, (NH4)2 S2O8.
При малих ί к лінійна залежність:
ή О2 = k ίк ,
де k - постійна, залежна від матеріалу катода і стану його поверхні, температури та ін.
При великих ί к та значній швидкості підводу кисню до катоду залеж-ність перенапруження іонізації кисню від щільності струму має логарифмічний характер ( рівняння Тафеля):
ή О2 = a + b lgίк ,
де a -постійна, залежна від матеріалу катода і стану його поверхні, темпе-ратури та ін.; b –постійна,пов'язана з механізмом виникнення перенапружен-ня.
Розчинність кисню у воді і водних розчинах мала і при =25 З, парціальному тиску в повітрі =21 кПа ( =101,3 кПа) складає 2,6 • 10-4 міль/л. Тому катодне відновлення кисню лімітується швидкістю його дифузії до поверхні і протікає з концентраційною поляризацією. Швидкість корозії з кисневою деполяризацією зростає при перемішуванні розчину, що обумовлене збільшенням коефіцієнта дифузії і розчинності кисню.
Корозію з кисневою деполяризацією уповільнюють деаерацією ( зниженням О2, знекисненням) корозійного середовища, що здійснюють або термічною, або хімічною обробками, або зменшенням тиску кисню над розчином. Зміна складу катодних ділянок мало впливає на швидкість корозії з поглинан-ням кисню, тому міра чистоти металу практично не грає ролі при цьому виді корозії.
б) Воднева деполяризація (перенапруження водню)
Процес катодного розряду водневихіонів гальмується, головним чином внаслідок повільного протікання самої електродної реакції, тобто внаслідок перенапруження водню, залежного більшою мірою від металу і стану поверхні катода.
Умови протікання процесів з водневою деполяризацією :
- Е(Ме рівн) < Е(Н2 рівн).
- достатня активність Н+ в розчині.
Стадії протікання :
- дифузія гідратованих іонів Н+ до катодних ділянок поверхні металу;
- розрядка водневих іонів;
- розчинення і дифузія атомів водню в металі;
- молізация атомів водню;
- утворення і відрив бульбашок Н2 від поверхні металу..
При корозії металів з водневою деполяризацією катодна реакція є зазвичай найбільш утрудненою стадією катодного процесу. В цьому випадку електрохімічну поляризацію катода називають перенапруженням водню ή Н2 :
ή Н2 = ЕН2 - ЕН2 рівн.
ή Н2 залежить від ίк , матеріалу катода і стану його поверхні, температури та ін.
При малих ί к лінійна залежність:
ή Н2 = k ίк ,
де k - постійна, залежна від матеріалу катода і стану його поверхні, температури та ін.
При великих ί к логарифмічна залежність ( рівняння Тафеля):
ή Н2 = a + b lgίк ,
де a - постійна, залежна від матеріалу катода і стану його поверхні, температури та ін.; b –постійна,пов'язана з механізмом виникнення перенапруження ( при 250С = 0,116).
Чим менше ή Н2 , тим вище швидкість корозії.
Підвищення концентрації Н2 на поверхні металу полегшує проникнення атомів водню в кристалічну решітку, що викликає водневу крихкість ( втрата пластичності) і може привести до раптового розтріскування сплавів на основі заліза.
Швидкість катодного виділення водню практично не залежить від пере-мішування розчину і зростає як з підвищенням температури відповідно до рів-няння Ареніуса, так і із збільшенням концентрації іонів водню, оскільки рівно-важний потенціал водневого електроду залежить від рН розчину.
Виділення водню на таких металах, як Pb, Zn, Cd , Hg протікає із значним перенапруженням. Їх присутність у складі сплаву або не міняє швид-кості корозії основного металу, або знижує її із-за зменшення площі поверхні, займаної основним металом, на якій і відбуваються розчинення металу і виді-лення водню. Такі метали, як Pt, Co, Ni володіють каталітичною дією в реакції катодного виділення водню, оскільки перенапруження виділення водню на них незначне.
Таким чином, корозія з водневою деполяризацією може бути сповільнена шляхом зниження температури, видалення з металу тих домішок, що каталізу-ють катодний процес , зменшення вмісту Н+ - іонів, ізоляції поверхні металу.
2.7 Корозійні діаграми
Корозійні діаграми дозволяють повною мірою застосувати основні закони електрохімічної кінетики до аналізу, розрахунків і прогнозів корозії.
Згідно електрохімічної теорії, реальна швидкість корозійного процесу буде визначається кінетикою (швидкостями) анодного і катодного процесів, залежних, від електрохімічних потенціалів, що встановлюються.
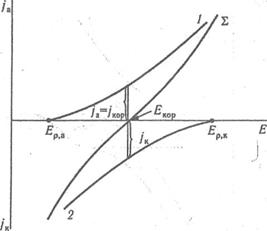
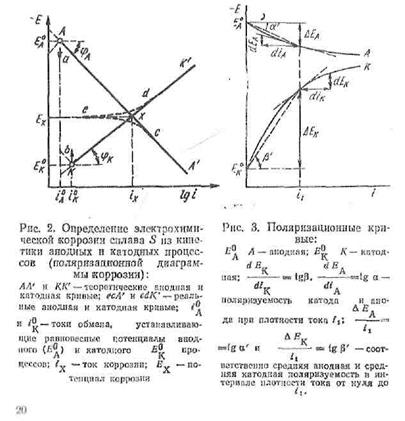
Зміна швидкості корозії, пропорційна корозійному струму, може бути наочно представлене графічно так званою поляризаційною діаграмою, тобто залежністю швидкостей анодного і катодного процесів від потенціалу (рис. 2).
|
Анодна і катодна реакції характеризуються рівноважними потенціалами Еарівн і Екрівн. відповідно. Одночасне протікання реакцій окиснення і відновлення на поверхні сплаву можливо при деякому проміжному потенціалі Екор., значення якого знаходиться між Еарівн і Екрівн.
Мал. 1 Поляризаційні криві, анодного (1) і катодного (2) процесів при корозії металу з водневою деполяризацією, Σ— сумарна поляризаційна крива.
Таким чином, основна умова виникнення корозійного процесу:
Еарівн < Екор < Екрівн..
|
|
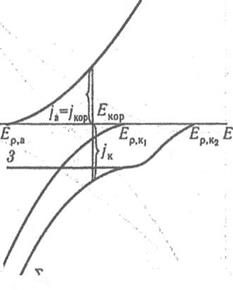
Мал. 3 Поляризаційні криві при корозії металу із змішаною деполяризацією: 1- растворення металу; 2 — відновлення іонів Н+; 3 — відновлення 02; Σ-суммарная катодна поляризаційна крива, що відповідає одночасному відновленню іонів Н+ и 02
В кислих середовищах з рН < 4 швидкість процесу відновлення H+ при корозії металів визначається реакцією:
2H+ +2 e- = H2
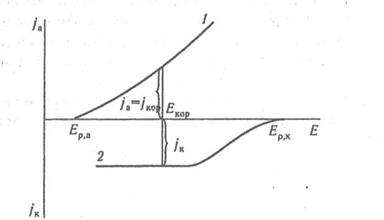
В цьому випадку корозія протікає з водневою деполяризацією. Оскільки концентрація іонів Н+ в кислих середовищах велика, те виділення водню ліміруєтся стадією розряду. На мал. 1 представлені поляризаційні криві анодного і катодного (2) процесів при корозії в кислих середовищах металів з Е(Ме n+/Ме) < 0 В.
Сумарна поляризаційна крива (Σ) проходить при потенціалі корозії че-рез 0, тобто сумарна швидкість процесів окиснення і відновлення при потенці-алі корозії в одиницях щільності струму дорівнює нулю і виміряти струм коро-зії безпосередньо не можна. Якщо рН розчину > 6, то концентрація іонів Н+ маленька, і на поверхні металу протікає реакція:
O2 + 2H2O + 4e- = 4OH-
В цьому випадку корозія протікає з кисневою деполяризацією. Оскільки концентрація кисню в розчинах електролітів, що знаходяться у контакті з повітрям, невелика (~ 4 · 10-3 г/100 г води), і потенціал корозії для заліза і сталі СТ30 істотно відрізняється від рівноважного потенціалу реакції відновлення O2 + 2H2O, то при потенціалі корозії досягається граничний дифузійний струм відновлення кисню (мал. 2).
В області 4 < рН < 6 швидкість корозії визначається спільним протікан-ням реакцій (2) і (3) (змішана деполяризація, мал.3).
Аналітично швидкість корозії К можна виразити наступним чином:
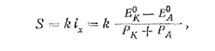
|
де (ЕК—ЕА) — ЕРС корозійного елементу, пропорційна зменшенню вільної енергії системи при корозії, така, що є рушійною силою корозійного процесу.
Електрохімічна корозія термодинамічно можлива, якщо ЕРС>0. Знаменник характеризує загальне кінетичне гальмування процесу електрохімічної корозії. Якщо в корозійній системі не має помітних омічних опорів, то знаменник виражений загальною катодною Рк і анодною Ра поляризуємістю, що характеризує утрудненість протікання катодного Рк або анодного Ра процесів.
З формули і діаграми (мал. ) видно, що зниженню швидкості електрохімічної корозії або зменшенню корозійного струму сприятиме:
1. Зменшення ступеня термодинамічної нестабільності, тобто зближення рівноважних потенціалів анодного Еа0і катодного Ек0процесів ( це показано стрілками а і в на діатрамме (див. мал. 2)).
2. Гальмування катодних процесів, тобто збільшення катодної поляризуємостіРк (збільшення кута нахилу φк катодною кривою).
3. Гальмування анодних процесів, тобто збільшення анодної поляризуємостіРа (збільшення кута нахилу φа анодної кривій).
У тих випадках, коли корозійне середовище має дуже малу провідність, як гальмуючий чинник також входить омічний опір R і вираз для швидкості корозії приймає вигляд
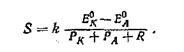
Про кінетику електродного процесу можна зробити висновки на підставі аналізу поляризаційної кривої, тобто по залежності між зсувом потенціалу електроду і щільністю струму, що протікає через електрод (мал. 3).
Крутий хід поляризаційних кривих відповідає великій поляризуємості електроду і, отже, великій загальмованості електродного процесу. Навпаки, пологий хід кривої, тобто мала полярізуємість, указує на безперешкодне протікання електродного процесу.
Аналізуючи стан корозійної системи за допомогою діаграм lg і = f(E), можна визначити, як необхідно змінити потенціал кородую-чого металу, щоб прискорити або загальмувати корозію.
2.8. Корозійні діаграми Еванса
Окремо отримані анодні і катодні поляризаційні криві ще не описують
швидкість корозійного процесу. Остання визначається швидкістю протікання найповільнішою, лімітуючою стадії. Цю стадію називають контролюючим чиннком. Для його визначення найбільшого поширення набув графічний метод.
По цьому методу аналіз корозійних систем прийнято проводити за допомогою діаграм, на яких графічно відбита кінетика анодної і катодної реакцій. На цих діаграмах значення потенціалу відкладається по ординаті, а по осі абсцис відкладають величини і анодного, і катодного струмів, незалежно від того, що вони мають протиставлений напрям (мал.).
 |
Вгору по ординаті відкладають негативні значення потенціалу. Відзначають стаціонарне значення Еа і Теньк і знімають анодну і катодну поляризаційні криві. Точка перетину цих кривых указывает на максимальну щільність струму корозії іmах.
При цьому встановлюється загальний потенціал корозії Екор.
Корозійні діаграми дозволяють визначити гальмуючий (контролюючий) чинник процесу корозії. Це дуже важливо при виборі методу захисту від корозії, оскільки, як правило, найефективніше впливати на лімітуючу стадію процесу.
Значнe поляризаці. процесу видно з великої величини нахилу відповідної поляризаційної кривої. Полога крива вказує на малу утрудненість реакції. Наприклад, при значній анодній поляризації і малій величині катодної поляризації потенціал корозії Екор близький до катодного потенціалу Ек до проходження струму. Якщо ∆Еа>>∆Ек, то корозія протікає з анодним гальмуванням, якщо ∆ЕК >> ∆ЕА, то корозія протікає з катодним контролем. Якщо ∆ЕК ≈ ∆ЕА — має місце змішаний контроль.
Н.Д. Томашов визначив, що в практичних умовах зустрічаються шість основних випадків контролю корозії, які представлені на мал .
Катодний контроль (∆ЕК >> ∆Еа):
А.Гальмуючий чинник - трудність реакції відновлення молекул О2. Зустрічається в нейтральних розчинах при хорошому перемішуванні.
Б. Гальмуючийчинник - дифузія кисню. Діаграма характерна для корозії в неперемішуваних нейтральних розчинах. Так корродіруют залізо, цинк і деякі інші метали.
В. Лімітуючий чинник - трудність реакції розряду іонів водню. Характерна для процесу корозії заліза і цинку в кислих розчинах.
Г. Змішаний катодно-анодний контроль(∆ЕК ≈ ∆Еа). Діаграма характерна для корозії заліза, сталей, алюмінію і інших металів в пасивному стані.
Д. Змішаний катодно-омічний контроль (∆Ек>>∆Еа,R≠0). Корозія протікає в середовищі з низькою електропровідністю. Наприклад, корозія підземних трубопроводів.
Е. Змішаний катодно-анодно-омічний контроль (∆Ек ≈ ∆Еа, R≠0). Спостерігається цей вид контролю у металів, схильних до пасивації при великому омічному опорі електроліту, наприклад, при атмосферній корозії сталей.
2.9. Вплив внутрішніх і зовнішніх факторів
на швидкість корозії
До внутрішніх факторів, що визначають швидкість, характер електрохімічної корозії, відносяться : стан поверхні, хімічний склад , структура металу і т. д. Неоднорідність поверхні металу є однією з причин місцевої корозії.
Ретельна, тонка обробка поверхні (шліфування, полірування) підвищує корозійну стійкість металів, сприяючи утворенню більш однорідної суцільної оксидної плівки на поверхні металу. При грубій обробці істинна поверхність контакту металу з агресивним середовищем збільшується, що підсилює корозію.
Зовнішні фактори, що впливають на швидкість корозії металів, визначаються природою і властивостями корозійного середовища та його параметрами (температура, тиск, швидкість руху розчину електроліту і т. д. )
| Внутрішні фактори | Зовнішні фактори |
| - склад сплаву; - кристалічна структура металу; - стан поверхні; - умови експлуатації; - схильність до пасивації | - склад електроліту; - концентрація окисників; - рН середовища; - температура; - тиск ( в разі оксигенної деполяризації); - швидкість руху електроліту |
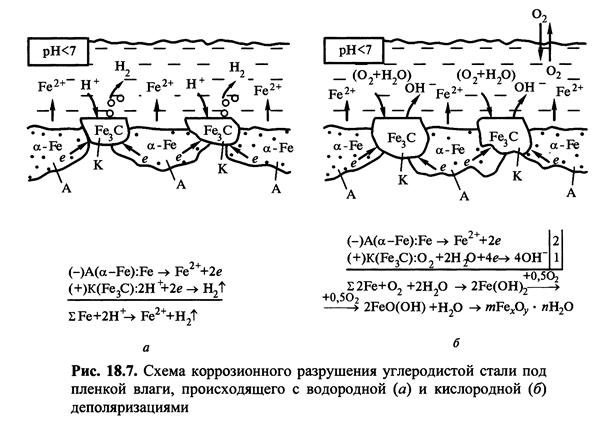
Вплив рН середовища. Концентрація іонів водню в розчині електроліту визна-чає швидкість електрохімічної корозії металів. Для благородних металів ( сріб-ла, золота, платіни) характерна висока корозійна стійкість в кислих, нейтральних і лужних середовищах, тобто швидкість корозії для цих металів не залежить від рН середовища . До металів малостойкіх в кислих середовищах відносяться залізо , магній, мідь, марганець .
При невисоких значеннях рН швидкість їх руйнування значна: легко виділяється водень, продукти, що утворюються в результаті корозії, розчинні. При рН від 4,0 до 8,5 швидкість корозії цих металів не залежить від рН, так як в цих умовах не змінюється розчинність кисню, основного катодного деполя-ризатора.
В лужних середовищах (рН > 10) відбувається утворення нерозчинних гідроксидів заліза, і швидкість корозії різко падає. При дуже високих концен-траціях гідроксид-іонів (рН > 13) утворюються розчинні феріти і гіпоферіти заліза, швидкість корозіі при цьому зростає.
Цинк, алюміній, олово, свинець стійкі в нейтральних середовищах, але руйнуються в лужних і кислих середовищах . Нестійкість цих металів у кислих та лужних середовищах пояснюється їх амфотерністью, тобто розчинністю оксидів цих металів в кислотах і лугах .
До металів, стійких в кислих, та нестійких в лужних середовищах, відно-сяться молібден, тантал, вольфрам .
До металів, малостойкіх в кислих середовищах, але стійким в лужних, відносяться нікель, кадмій . Для кожного металу є певне значення рН розчину електроліту, при якому швидкість корозії мінімальна, наприклад, для алюмінію - 7,0; свинцю - 8,0; олова - 9,0; цинку - 10,0; заліза-14,0.
Влияние рН среды
| металл | Устойчивость в кислой среде | Устойчивость в щелочной среде | Устойчивость в нейтральной среде | |
| рН до 4 | 4 - 8,5 | >10 | ||
| Fe | малост., прод кор. раств. | скор. не завис. от рН | нераств . гидрокс. скорость резко падает =14 раств. ферриты, скор. растет | |
| Mg | малост., прод кор. раств. | - - - | ||
| Cu | малост, прод кор. раств. | - - - | ||
| Mn | малост., прод кор. раств. | - - - | ||
| Al,Sn,Pb,Zn | неустойчив | неустойчив | устойчив | |
| Mo. Tn.W | устойчив | неустойчив | ||
| Ni. Cd | неустойчив | устойчив | ||
| Ag. Au. Pt | высокая стойкость во всех средах, скорость кор. не зависит от рН среды |
Вплив температури на швидкість корозії. Зміна температури зовнішнього середовища значно впливає на швидкість корозії, тому що збільшується швидкість дифузії, розчинність продуктів корозії, величина перенапруження на електродах. При підвищенні температури середовища швидкість електрохімічної корозії, як правило, зростає (мал. ).



Мал. . Температурна залежність окислення феруму в координатах: Кm+ - t0C (а) та lg Кm+— 1/Т (6).[3].
У цьому випадку залежність швидкості корозіі К від температури Т виражається рівнянням наступного виду:
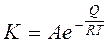 ,
,
де А - константа; е - основа натуральних логарифмів; Q - величина енергії активації; R - молярна газова стала (8,31 Дж/моль К). Після логарифмування рівняння носить лінійний характер:
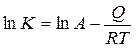 .
.
Такий вид залежності справедливий для швидкості корозії неблагородних металів у мінеральних кислотах (мал.), тобто в процесах, що протікають з водневою деполяризацією. Можливі виключення із зазначеного правила, що пов'язано з появою захисних властивостей в продуктах корозії або зменшенням розчинності кисню в електроліті з підвищенням температури у відкритих системах.
Вплив тиску на швидкість корозії. Основна причина впливу тиску на швидкість електрохімічної корозії - зміна розчинності газу, що бере участь в цьому процесі.
Тому при збільшенні тиску збільшується швидкість корозійних процесів, що йдуть з кисневою деполяризацією, і тиск не впливає на процеси, що йдуть з водневою деподярізацією. Підвищення тиску та температури збільшує швидкість корозії (карбонільної корозія вуглецевих сталей). Вплив швидкості руху електроліту на швидкість корозії. Кожний прилад, апарат і т. п. працює в умовах, коли розчин електроліта переміщується або перемішується.
При переміщенні електролітів, що не мають у своєму складі значних кількостей агресивних іонів, залежність швидкості корозії від швидкості потоку рідини можна представити кривою (мал. 51) з трьома характерними ділянками: 1 - зі збільшенням швидкості руху розчину електроліта швидкість корозії збільшується, тому що збільшується швидкість дифузії кисню до поверхні контакту метал - електроліт; 2 – швидкість корозії зменшується, тому що на поверхні металу утворюється захисна оксидна плівка; 3 - швидкість корозії різко зростає через механічне видалення захисної плівки (ерозії) потоком електроліту, що рухається .
Швидкість руху електроліту значно впливає на процес корозії, що протікає з кисневою деполяризацією, ніж з водневою. Якщо під час руху електроліту на окремих ділянках поверхні металу чергується низький і високий тиск, то спостерігається посилене руйнування не тільки захисних плівок, а і металевої поверхні. Це явище називають кавітаціоною ерозією. Такий вид руйнування характерний для втулок циліндрів дизелів з боку грібних гвинтів, що охолоджуються водою, лопат гідравлічних турбін. Руйнування, викликані кавіта-ційною ерозією, проявляються у вигляді тріщин, поглиблень, раковин. Агресивність середовища сприяє руйнуванню металу кавітаціонною ерозією.
Вплив складу нейтральних розчинів. Зі збільшенням концентрації розчину швидкість корозії спочатку зростає, а потім падає. Така залежність є типовою для процесів корозії металів в нейтральних розчинах солей (мал. 52). Оскільки процес корозії в цьому разі залежить від кисневої деполяризації, підвищення швидкості корозії не можна пояснити тільки впливом розчиненого кисню, тому що розчинність кисню знижується при підвищенні концентрації солі в розчині. Наявність вихідної гілки на зазначеній залежності пов'язане зі збільшенням електропровідності розчину і відповідної активізації анодного процесу. При підвищенні концентраціі солі в розчині вище 3% NaС1, подальше зниження розчинності кисню стає переважаючим фактором, і швидкість корозії знижу-ється.
Розчини солей інших лужних металів (наприклад, КС1) впливають на швидкість корозії аналогічним чином. Розчини солей лужноземельних металів дещо менш корозійно активні, ніж солі лужних металів.
На процес корозії більшості металів в розчинах солей істотно впливає природа аніону солі (рис. 53). Розчини цих солей не сприяють створенню нероз-чинної захисної плівки на поверхні металів (за винятком іона СІ- для молібдену і іони F- для магнію). Найбільш агресивними є розчини, що містять фторид-іони, і замикають групу розчинів, що містять йодид-іони. Розчини солей, що володіють окисними властивостями, підвищують швидкість електрохімічної корозії металів, якщо ці розчини є катодними деполяризаторами.
3. ЛОКАЛЬНІ ВИДИ КОРОЗІЇ І КОРОЗІЙНО-МЕХАНІЧНІ РУЙНУВАННЯ МЕТАЛІВ
3. 1. Локальні види корозії
Локальні корозійні процеси реалізуються на порівняно невеликих за площею ділянках поверхні металу і розвиваються з високою швидкістю. В результаті відбувається швидка втрата металевими конструкціями експлуатаційних властивостей внаслідок руйнування їх порівняно невеликих ділянок. Постійне посилювання умов експлуатації металевого устаткування і залучення до промислової сфери все нових металевих конструкційних матеріалів приводить до того, що з часом доля локальних корозійних руйнувань неухильно зростає. До основних видів локальної корозії відноситься пітингова, виразкова, щілинна, міжкристалітна, селективне витравлення і контактна корозія.
Пітингова корозія (ПК)є одним з найбільш небезпечних видів локальної корозії. До неї схильні багато металів і сплавів, що пасивують. До пітингової корозії схильна переважна більшість металів (Fе, Ni, Co, Мn, Сr, Тi, А1, Мg, Zr, Та, Сu, Zn і ін.) і конструкційних матеріалів на їх основі.Пітингова корозія виникає в морській воді, розчинах солей, в системах холодильних машин, що охолоджують, в системах оборотного водопостачання хімічних підприємств. Термін «пітинг» застосовують для опису як точкової корозії, так і специфічних корозійних руйнувань . Назва «пітинг» зазвичай використовують стосовно глибоких точкових руйнувань.
Для протікання пітингової корозії необхідне виконання ряду умов:
• пітинг утворюється на поверхні металів, що знаходяться в пасивному стані,
• розвитку пітингу сприяють дефекти пасивуючої плівки (структурні неоднорідності, сторонні включення, пори). Особливо уразливі для пітингу ребра, границі лакофарбних покриттів;
• у розчині мають бути одночасно присутніми активатори пітингової корозії і пасиватори металу. Стимуляторами пітингової корозії металів у водних середовищах є іони С1-, Вг-, I- , СN-, SO42-.
Виразкова корозіяпо характеру свого розвитку дуже нагадує ПК, проте локалізація корозійного процесу при цьому менш гостра, і діаметр вогнищ виразкової корозії значно більше, чим при ПК. Діаметр виразок, як правило, істотно більше їх глибини.
Виразкова корозія протікає як на пасивних, так і на металах, що активно розчиняються. Підвищеною схильністю до виразкової корозії володіють вуглецеві і низьколеговані сталі. Виразкова корозія, як правило, протікає на поверхні активних металів (в деяких випадках корозійні виразки можуть утворюватися і при злитті пітингів, що виникають на пасивному металі), що розчиняються, і по характеру свого розвитку нагадує пітингову корозію, внаслідок чого чітка кваліфікація локального корозійного процесу буває утруднена. Схильністю до виразкової корозії володіють вуглецеві і низьколеговані стали, такі, що експлуатуються у водних хлоридвмісних середовищах, наприклад, водоводи, водопроводи, теплоенергетичне обладнання.
Щілинна корозіявиявляється в умовах, коли внаслідок близькості розташування двох поверхонь (тобто в місцях застою розчину) виникають вузькі зазори або щілини. При цьому не має великого значення, що є причиною утворення щілини — особливості металевої конструкції або властивості структури металу. До щілинної корозії схильні багато металів і металеві вироби.
Межкрісталлітная корозія(МКК) виникає в полікристалічних матеріалах, переважно сплавах заліза, алюмінію і міді, протікає на кордонах зерен і є наслідком відмінності хімічного складу тіла зерна і його зернограничних областей.
До межкристалітної корозії (МКК) схильні металеві матеріали, що легко пасивуються, наприклад, неіржавіючі сталі, сплави на основі нікелю, алюміній і його сплави. Причиною МКК є прискорене розчинення металу границь зерен . Коли швидкість розчинення граничних областей на декілька порядків перевищує швидкість розчинення основного металу відбувається порушення зв'язку між окремими зернами металу і їх подальша крихкість, внаслідок якого металеві конструкції втрачають свої експлуатаційні властивості.
Селективне витравленняхарактерне для конструкційних матеріалів, що складаються з двох або більшої кількості фаз, що значно відрізняються за своїми властивостями, внаслідок чого одна з них піддається переважному розчиненню, тоді як інші розчиняються з набагато нижчими швидкостями. Це приводить до утворенню в металі порожнин різної глубини і конфігурації, внаслідок чого метал втрачає свою суцільність, а, отже, і експлуатаційні якості.Цей вид розчинення характерний для неіржавіючих сталей, коли селективному розчиненню піддаються карбіди, що виділяються по кордонах їх зерен . Контактна корозія розвивається при виникненні контакту між двома або більш різнорідними металами.
Дата добавления: 2015-11-06; просмотров: 1396;
