Склад газового середовища 1 страница
Вплив складу газового середовища на швидкість корозії металів великий, специфічний для різних металів і змінюється з температурою.
Нікель, відносно стійкий в середовищі О2, H2O, CO2, дуже сильно кородує в атмосфері SO2.
Мідь найшвидше кородує в атмосфері оксигену, але стійка в атмосфері SO2. Хром же володіє високою жаростійкістю у всіх чотирьох атмосферах.
Склад газового середовища надає великий вплив на швидкість окиснення заліза і сталі. Особливо сильно впливають оксиген, сполуки сірки і водяні пари. про що свідчать приведені нижче дані про залежність відносної швидкості корозії (%) сталі з 0,17% С від складу газового середовища при 900°С (за Гатфілдом).
| Склад газового середовища | Відносна швидкість корозії (%) |
| Чисте повітря Чисте повітря + 2% SO2 Чисте повітря +5% H2O Оксиген Повітря + 5% SO2 + 5% H2O |
Насичення повітря парами води збільшує швидкість корозії сталі в 2-3 рази. За наявності в газовому середовищі сполук сірки залізо і сталь часто піддаються міжкристалітній корозії.
Якщо газовим середовищем є продукти горіння палива, тo газова корозія вуглецевих і низьколегованих сталей тим сильніше, чим вище коефіцієнт витрати повітря, з яким спалюється паливо. Присутність в газовому середовищі SO2 значно збільшує корозію вуглецевих сталей .
Підвищення вмісту в газовому середовищі оксиду карбону СО дуже знижує швидкість корозії вуглецевих і низьколегованих сталей , проте при великій кількості СО у газовій фазі може відбутися навуглецювання поверхні сталі.
Відмінності в швидкості корозії металів в різних газових середовищах в значній мірі визначаються захисними властивостями продуктів корозії, що утворюються на металах плівок.
1.5.3. Тиск газів
При зниженні парціального тиску окиснюючого компоненту нижче за тиск дисоціації сполуки, що утворюється, метал стає термодинамічно стійким і його окиснення припиняється.
Якщо швидкість окиснення металу визначається швидкістю поверхневої реакції (наприклад, взаємодія Ni з газоподібною сіркою S2 за реакцією Ni +1/2 S2 = NiS), то швидкість окиснення пропорційна кореню квадратному з величини тиску газу. Така закономірність спостерігається, якщо газ впливає на голу поверхню металу, тобто у відсутність захисної плівки.
Якщо швидкість загальної реакції взаємодії металу з газовою фазою визначається швидкістю процесу дифузії в шарі утворюючого продукту корозії, то залежність швидкості окиснення від тиску окиснюючого газу може бути абсолютно іншою і різною для різних поверхневих сполук.
1.5.4. Режим нагріву
Коливання температури при нагріві або експлуатації металів при високих температурах, особливо змінні нагрівання і охолоджування, збільшують швидкість окиснення металів, наприклад заліза і сталей, оскільки в захисній оксидній плівці внаслідок виникнення в ній термічної напруги утворюються тріщини і вона може відшаровуватися від металу, тобто порушується збереження захисної плівки у зв'язку з низькою її термостійкістю. В ряді випадківтермостійкість може бути підвищена за рахунок внутрішнього окиснення сплаву, сприяючого вростанню окалини, що утворюється, на металі.
1.5.5. Склад сплаву і плівки
Захисні властивості поверхневих плівок залежать від природи і складу сплаву.
При високих температурах (вище 800 °С) швидкість окиснення сталі зменшується в міру підвищення вмісту в ній вуглецю. Зневуглецювання сталей при цьому також зменшується. Це пов'язано з інтенсифікацією процесу утворення оксиду вуглецю (II) — СО.
Сірка, фосфор, нікель і марганець, присутні в сплаві, практично не впли-вають на високотемпературне окиснення заліза, а титан, мідь, кобальт і берилій трохи знижують швидкість газової корозії. Хром, алюміній і кремній сильно уповільнюють окиснення заліза внаслідок утворення міцних захисних оксидних плівок. Ці елементи широко застосовують для легування сталі з метою підвищення її жаростійкості . Хром, введений в сталь в кількості до 30%, значно підвищує її жаростійкість.
Алюміній вводять в сталь в кількості до 10%, що ще більше підвищує її жаростійкість. Аналогічною властивістю володіє кремній при введенні його в сталь в кількості до 5 %. Проте сталі з високим вмістом алюмінію і кремнію володіють підвищеною крихкістю і твердістю, що утрудняє їх обробку. Тому основою жаростійкого легування є система Fe-Сг з додатковим введенням кремнію і алюмінію в кількості до 4-5 %.
Ванадій, вольфрам і молібден сильно прискорюють окиснення сталі при високій температурі. Це обумовлено летючістю і легкоплавкістю утворюваних ними оксидів.
При високій температурі більш жаростійкою є аустенітна структура сталі. Із збільшенням вмісту фериту жаростійкість двофазних сталей зменшується, а ступінь окиснення підвищується. Це пояснюється тим, що на двофазних сталях утворюються плівки з великою внутрішньою напругою, що приводить до їх руйнування. Деформація металу також сприяє руйнуванню плівки і збільшує швидкість корозії.
Вплив складу сплаву на швидкість корозії
| № | Легуючі елементи | Вплив на швидкість окиснення |
| 1. | С ( >8000С) | Чим вище концентрація карбону в сталі, тим нижче швидкість окиснення. Аустенітна структура (γ Fe+C ,грати кубічні гранецентровані) більш жаростійка, ніж ферітна структура ( α Fe+C , грати кубічні об'емоцентровані) . Двофазні сталі утворюють плівки з великою внутрішньою напругою. |
| 2. | S, P, Ni, Mn | Практично не впливають на високотемпературне окиснення заліза. |
| 3. | Ti, Cu, Co, Be | Трохи знижують швидкість корозії |
| 4. | Cr ( до 30%), Al (до10%), Si (до 5%) | Значно уповільнюють швидкість окиснення заліза внаслідок утворення на поверхні якісних захисних плівок, підвищують жаростійкість |
| 5. | V, W, Mo | Значно прискорюють окиснення сталі при високій температурі внаслідок летючості і легкоплавкості їх оксидів. |
1.6. Деякі види газової корозії заліза, сталі, чавуну
і інших металів і сплавів.
Зростання чавунів. Воднева корозія. Карбонільна корозія.
Корозія в середовищі хлору і хлороводню. Корозія під дією продуктів
згорання палива
При нагріванні вище 6000С залізо і вуглецеві сталі покриваються плівкою - окалиною, що має складну будову. Товщина шару різних оксидів залежить від температури, часу корозії і складу газового середовища.
У сталі разом з окисненням заліза, відбувається взаємодія карбіду заліза з киснем повітря і кисневмісними речовинами:
Fe3C + О2 = 3Fe+ CO2
Fe3C+ CO2 = 3Fe+ 2CO
Fe3C + H2 O = 3 Fe + СО + H2
В результаті поверхневий шар обідняється вуглецем, що приводить до зміни структури сплаву і погіршує його механічні і антикорозійні властивості.
Зміст домішок марганцю, сульфуру, фосфору не надає помітного впливу на корозію сталі.
В особливий випадок газової корозії чавунів («зростання чавунів») виділяють високотемпературні процеси селективного, внутрішнього окиснення. Утворення окалини в цьому випадку протікає на межах зерен кристалітів сталістої основи і на поверхні включень графіту. Із-за більшого об'єму оксидів компонентів чавуну, що утворюються, розміри деталі збільшуються, а її міцність знижується. Більше всього сприяють процесам «зростання» чавуну теплові удари.
Наявність кремнію у складі чавунів збільшує їх схильність до «зростання», а чавуни, леговані хромом і нікелем, добре чинять опір такому виду корозійного руйнування. Істотне значення при прогнозуванні жаростійкості чавунів має форма графітових включень. При кулястій формі вкраплень графіту стійкість хромистих чавунів проти газової корозії вища, ніж у чавунів з пластинчастими включеннями графіту.
Сталь і чавун звуглероджуються також в середовищі водню з утворенням метану:
t,p
Fe3C + 2H2 = 3Fe + CH4
Цей вид газової корозії ( воднева),спостерігається при взаємодії водню із залізовуглецевими сплавами при високих температурах і тиску, наприклад в колонах синтезу аміаку (процес синтезу аміаку ведуть при 450-5500С і тиску 25-100 МПа). Для попередження зневуглецювання стали при високих температурах застосовують леговані стали. Як легуючі добавки вводять елементи, здатні утворювати карбіди, стійкіші по відношенню до водню, чим цементіт FезС.
Карбонільнакорозія- процес руйнування металів при взаємодії їх з оксидом вуглецю (II), який при високому тиску і температурах, як наприклад, в процесах отримання синтетичних спиртів (метилового, бутилового і ін.), може утворювати з металами легко сублімуючі карбоніли:
Ме + п СО = Ме(СО)n
Для заліза реакція йде з утворенням пентакарбонілу:
Fe + 5(CO) = Fe(CO)5
Пентакарбоніл заліза Fe(CO)5 - рідина, кипляча при 1020С,, пари її повністю дисоціюють на Fe і CO при тиску 0,1 MПa і температурі вище 1400С.
При карбонільній корозії відбувається руйнування поверхневого шару металу і розпушування його на глибину до 5 мм. Як попереджувальні заходи до складу сталі вводять легуючі добавки. Проте необхідно відмітити, що нікель при взаємодії з оксидом вуглецю (II) утворює легко киплячий тетракарбоніл нікелю Ni(CO)4.
Не схильні до карбонільної корозії хромисті сталі із змістом 30% Cr, хромонікелеві сталі (23% Cr и 20% Ni) і марганцевиста бронза при температурі до 7000С і тиску до 35 MПa.
Корозії під дією хлору і хлороводнюсхильні практично всі метали. Хлориди металів , що утворюються в результаті такої взаємодії MeCl2 або MeCl3 плавляться або розкладаються при підвищенні температури.
Реакція взаємодії Me + Cl2 = MeCI2 має екзотермічний характер, і оскільки при цьому швидкість відведення теплоти може бути нижче за швидкість реакції, то метали «горять» в атмосфері хлора. От чому цей вид корозії принципово відрізняється від інших, що протікають в газових середовищах .
Найбільш стійкі по відношенню до хлора і хлороводню нікель, хромонікелеві сталі, свинець, чия взаємодія з хлором не супроводжується екзотермічним ефектом, а плівки, що утворюються на їх поверхні, володіють захисними властивостями.
Корозія під дією продуктів згорання палива
Продукти згорання палива (вугілля, рідких вуглеводнів, мазуту і ін.) містять значну кількості сполук сульфуру і ванадію, що впливають на швидкість газової корозії В цих умовах корозія вуглецевих і низьколегованих сталей тим сильніше, чим вище коефіцієнт витрати повітря на згорання палива.
За наявності в середовищі сполук сірі залізовуглецеві сплави схильні до межкристалітної корозії. Це можна пояснити великим числом дефектів в кристалічних решітках сульфідів, порівняно з решітками оксидів, що приводить, у свою чергу, до прискорення дифузійних процесів і інтенсифікації корозії. Механізм впливу сполук ванадію такий: при спалюванні дешевого забрудненого ванадієм рідкого палива (мазуту, погонів нафти), утворюється велика кількість золи, що містить пентаоксид ванадію (V2O5). Зола, налипаючи на поверхню металу, збільшує швидкість його окислення і викликає межкрісталлітную корозію при температурах вище за tпл золу. Розглянемо причини, що викликають ванадієву корозію:
а) легкоплавкість V2O5 і його здатність переводити в рідкий стан хімічні сполуки золи і окалини (знижуючи тим самим захисні властивості окалини);
б) активна участь V2O5 в процесі окиснення металу:
Fe2O3 + V2O5 = 2Fe VO4
6FeVO4+4Fe = 5Fe2O3 + 3V2O3
4Fe + 3V2O5 = 2Fe2O3 + 3V2O3
V2O3+ O2=V2O5
З рівнянь реакцій видно, що пентаоксид ванадію практично не витрачається в процесі окиснення заліза. Взаємодія з різними оксидами заліза, хрому, нікелю, V2O5 руйнує захисні оксидні плівки, формуючи в них пори, по яких до поверхні активного металу досить легко проникають кисень газової фази і рідкий V2O5, що окиснюють метал.
З підвищенням вмісту в продуктах згорання палива оксиду вуглецю (II) помітно знижується швидкість газової корозії вуглецевих і низьколегованих сталей, проте при високих концентраціях СО у газі можливе навуглецювання поверхністалі, згідно реакції:
3Fе + 2СО = Fе3С + СО2
При цьому погіршується пластичність сталі.
1.7 Методи захисту від газової корозії.
1)Основний методзахисту в машинобудуванні - використання жаростійких і жароміцних сталей і сплавів. Так для зниження швидкості окиснення заліза при 9000С удвічі достатнє його легування 3,5% Al, а для зниження швидкості корозії вчетверо — 5,5% Al.
2) Інший традиційний метод - захист поверхні металу спеціальними жаростійкими покриттями (наприклад, дифузійне насичення поверхні Al, Cr, Si). При температурах до 20000С хорошими захисними властивостями володіють металокерамічні покриття (кермети).
3) Як захист від газової корозії використовують захисні атмосфери (при термообробці і зварці). Залежно від природи металу газове середовище не повинне містити окисників ( для сталі), або відновників (для міді). Найчастіше застосовують наступні захисні атмосфери: благородні гази (аргон, азот), топкові гази (N2-CO2- CO - H2- H2O ), продукти дисоціації аміаку ( N2 - H2 ), глибокий вакуум.
1.7.1 Теорія жаростійкого легування
У багатьох хімічних процесах металеві конструкції і вироби експлуатуються в жорстких умовах, при підвищених температурах, значному тиску, високій агресив-ності середовища.
Чисті метали, як правило, є корозійностійкими і не вимагають додатко-вих засобів захисту.
Сучасна техніка протикорозійного захисту володіє багатьма ефективни-ми засобами для збільшення стійкості металів і термінів їх експлуатації. Стосовно умов газової корозії, одним з найчастіше використовуваних способів є жаростійке легування з метою отримання сплавів, що володіють підвищеною корозійною стійкістю.
Існує декілька теорій жаростійкого легування, які не суперечать, а швид-ше доповнюють одна одну.
Згідно теорії, розробленої Вагнером і Хауффе, невелика добавка легуючого елементу окиснюється і, розчиняючись в оксиді основного металу, зменшує число дефектів в кристалічній решітці основного металу. Це приводить до впорядковування структури і знижує швидкість дифузії іонів в захисній плівці.
Дана теорія має досить обмежену область застосування. Якщо швидкість окиснення металу визначається не дифузією іонів або при легуванні в оксидній плівці утворюється нова фаза, то викладені вище припущення жаростійкого легування непридатні.
Згідно теорії, розробленою А.А. Смірновим, Н.Д.Томашовим і ін., на поверхні металу утворюється захисний оксид легуючого елементу, який перешкоджає окисненню основного металу.
Стосовно цієї теорії легуючий компонент повинен володіти перерахованими нижче основними властивостями.
1. Оксид легуючого елементу повинен задовольняти умові суцільності
2,5 > Vок/VМе > 1.
2. Легуючий елемент повинен утворювати оксид з високим електричним опором. Великий омічний опір (низька електропроводимість) є одним з основних умов для формування захисних властивостей плівки, оскільки при цьому гальмується рух іонів в шарі оксиду .
3. Енергія утворення оксиду легуючого елементу повинна бути більше енергії утворення оксиду основного металу E(Ме'O) > E(МеO)
де Ме' — легуючий компонент; Ме — основний метал.
Цю умову забезпечує стійкість оксиду легуючого компоненту у присутності основного металу. Оксид компоненту добавки виявляється стійкішим, ніж оксид основного металу. Якщо ця умова не дотримується, то оксид легуючого елементу відновлюватиметься основним металом.
Більш того, якщо спочатку утворюється змішаний оксид, то надалі відповідно до умов термодинамічної рівноваги, він переходить в чистий оксид легуючого компоненту.
Наприклад, при окисненні заліза легованого алюмінієм, має місце утворення оксиду заліза FеО. Але далі можливий процес:
ЗFеО + 2А1 = А12О3 + ЗFе.
4. Розмір іонів легуючого елементу повинен бути менше, ніж розмір іона основного металу (див. табл. 3.6). Це полегшує дифузію легуючого елементу до поверхні сплаву, на якому утворюється захисна плівка.
5. Оксиди легуючих компонентів повинні мати високі температури плавлення і сублімації і не утворювати низькоплавких евтектік. Ця вимога забезпечує збереження оксиду при високих температурах в твердій фазі. Перехід оксиду в рідкий стан полегшив би протікання в нім дифузійних процесів. Часткова сублімація оксиду збільшила б пористість плівки, що сприяє зниженню її захисних властивостей.
6. Легуючий компонент і основний метал повинні утворювати твердий розчин при даному складі сплаву. Тільки за цієї умови вдається забезпечити суцільну плівку оксиду легуючого компоненту по всій поверхні сплаву.Ця теорія жаростійкого легування знаходиться в хорошій згоді з практичними даними.
Розділ 2 ЕЛЕКТРОХІМІЧНА КОРОЗІЯ МЕТАЛІВ
Електрохімічна корозія- самовільне руйнування металів в середовищі електролітів, при якому окиснення атомів металу і відновлення окисника проті-кають як два незалежних, але зв'язаних процеси і їх швидкості залежать від зна-чення електродних потенціалів.
Причиною електрохімічної корозії є термодинамічна нестійкість металу в середовищі електроліту (електроліт - розчини солей, кислот, лугів, що прово-дять електричний струм).
2.1 Поняття про електродний потенціал
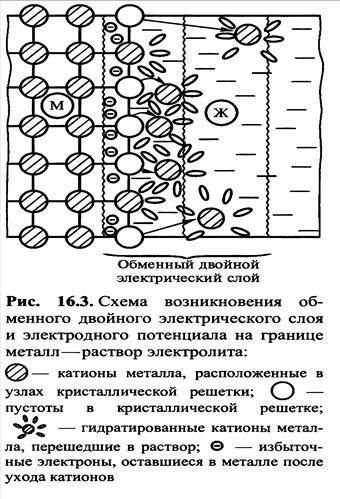
Електродний потенціал (Е)- це різниця між потенціалом металу і розчином його солі, в який він занурений.
При зануренні металу в розчин його солі відбувається розрив зв'язку між іонами металу і електронами, і іони переходять в розчин
Ме0 – nе- = Меn+ ,
при цьому на поверхні металу залишається еквівалентне число електронів, які заряджають поверхню металу негативно.
|


|



Таким методом визначають значення стандартних електродних потен-ціалівметалів Е0, що знаходяться в рівновазі з власними іонами (рівноважні, або оборотні потенціали).
Рівноважний електродний потенціал залежить від природи металу і розчинника, температури електроліту, активності іонів металу. Значення тако-го потенціалу (Е) можна розрахувати за рівнянням Нернста:
Е = Е0 + (RТ/nF)ln αMen+ ,
де Ео – стандартний потенціал металу, В; R – газова стала: R = 8,314 Дж/моль К; Т – абсолютна температура, К; n – ступінь окиснення іона металу; F – стала Фарадея: F=96500 Кл; αMen+- активність іонів металу, моль/л.
Підставивши в приведене рівняння значення всіх констант при 25оС і перейшовши від натуральних логарифмів до десяткових, отримаємо
Е = Е0 + (0,059/n)lg αMen+
 |
2.2. Умови виникнення нерівноважного потенціалу
Рівняння Нернсту дозволяє розрахувати значення потенціалу металу, зануреного в розчин власних іонів. В цьому випадку відбувається обмін іонами між металом і розчином

 Ме - пе- Mеn+,
Ме - пе- Mеn+,


 і швидкість відновлення іонів металу, виражена через щільність струму ірозр. ( струм розряду), дорівнює швидкості розчинення металу ііоніз.( струм іонізації): ірозр.= ііоніз.=іобм.
і швидкість відновлення іонів металу, виражена через щільність струму ірозр. ( струм розряду), дорівнює швидкості розчинення металу ііоніз.( струм іонізації): ірозр.= ііоніз.=іобм.
Швидкість обміну іонами металу між металом і розчином при рівноважному потенціалі називають струмом обміну іобм.
Схема встановлення рівноважного потенціалу показана на мал. 4, а.
Таким чином, при встановленні рівноважного потенціалу межу метал - розчин перетинає тільки один вид іонів - катіони металу. При цьому спостерігається баланс по зарядах і баланс по речовині, тобто корозія відсутня.
В реальних умоваху взаємодії металу і електроліту беруть участь не тільки катіони даного металу, але і інші іони (або молекули). Стале при цьому значення потенціалу називається нерівноважним, або необоротним. У таких умовах анодна реакціязабезпечується в основному іонами металу, а катодна -іншими іонами, наприклад, іонами водню, присутніми в електроліті. Необоротний потенціал виникає, наприклад, при зануренні цинку в розчин сірчаної кислоти Zn ⁄ H2SO4.
B цьому випадку анодна реакціяполягає в розчиненні цинку:

 Zn – 2 e- Zn2+
Zn – 2 e- Zn2+
а катодна- у виділенні водню:

 2H+ +2 e- H2
2H+ +2 e- H2
Значення необоротних потенціалів визначають експериментальним шляхом, оскільки їх не можна розрахувати за рівнянням Нернста.
Стале значення необоротного потенціалу в результаті рівності сумарних швидкостей можна зміряти по щільності струму катодних ік і анодних процесів іа: ік = іа = ікор .
Сталий в даному випадку потенціал називається стаціонарним (необоротним) потенціалом корозії .
Таким чином, при потенціалі корозії дотримується баланс електрич-них зарядів, але відбувається зміна маси металув результаті його електро-мічного розчинення (корозії).
На значення необоротного потенціалувпливають: температура, перемішування розчину і концентрація його, природа і стан поверхні металу.
Необоротні потенціали визначають швидкість електрохімічної корозії. Чим більш негативне значення має потенціал металу, тим більше можливість переходу металу в іонний стан, тобто швидкість електрохімічного розчинення.
Потенціал корозії Екор і струм корозії iкор є основними характеристиками корозійного процесу.
2.3 Механізм електрохімічної корозії
При електрохімічній корозії, якщо поверхня металу містить вкраплення інших металів, виникають енергетично різнорідні ділянки, на яких протікають процеси, аналогічні катодним і анодним реакціям в електрохімічному ланцюзі ( мікрогальванічна пара).
Механізм електрохімічної корозії зводиться до виникнення і функціонування корозійних гальванічних макро- і мікроелементів, тому їх процеси аналогічні процесам, що протікають в хімічних джерелах струму: гальванічних і паливних елементах, акумуляторах.
Основна відмінність корозійних процесів – відсутність зовнішнього ланцюга. Електрони в процесі корозії не виходять з кородуючого металу, а переміщаються в середині нього від анодних ділянок до катодних.
Основна відмінність механізму електрохімічної корозії від механізму хімічної корозії полягає в тому, що загальна реакція взаємодії металу із зовнішнім середовищем може розділятися на три основні процеси:
1) анодний процес– окиснення більш активного металу і перехід металу в розчин у вигляді іонів Меn+ .
Анод є донором електронів і на його поверхні протікає реакція окиснення ( втрата електронів) металу:
Ме - nе- = Меn+
Іони металу, що утворюються на анодних ділянках металу, переходять в розчин у вигляді гідратованих або сольватованих катіонів.(мал. ).
2) перетікання електронів по металу від анодних ділянок до катодних і відповідного переміщення катіонів і аніонів в розчині;
3) катодний процес– відновлення окисників(деполяризаторів) на поверхні катоду.
До деполяризаторів, що найчастіше зустрічаються, відносяться молекули кисню, води і іони водню Н+. Основними катодними реакціями з їх участю при електрохімічній корозії є:
1) в аерованих (насичених киснем) корозійних середовищах:
- нейтральних і лужних ( рН ≥ 7)
К(+): O2 + 2H2O + 4e- = 4OH- , ЕО2 ,2H2O /4ОН- = 0,40 В ;
- кислотних ( рН < 7)
К(+): O2 + 4H+ + 4e- = 2H2O, ЕО2 ,4H+/2H2O = 1,23 В ;
2) в деаерованих (що не містять розчинений кисень) корозійних середовищах: - нейтральних і лужних ( рН ≥ 7)
К(+): 2H2O + 2e- = Н2 + 2OH- , Е2H2O / H2 ,2OH- = -0,83 В
- кислотних ( рН < 7)
К(+): 2H+ + 2e- = Н2 , Е2Н+/ H2 = 0 В
Дата добавления: 2015-11-06; просмотров: 1034;

 - катіони металу в узлах кристалічної решітки;
- катіони металу в узлах кристалічної решітки;