Збиток навколишньому середовищу.
Економічний чинник є головною рушійною силою більшості корозійних дослід-жень. Витрати на відшкодування корозійних втрат у військовій техніці, комунальному господарстві обчислюються мільярдами доларів на рік.
Розрізняють прямі і непрямі корозійні втрати.
| Втрати | |
| Прямі (можна підрахувати) | Непрямі (важко підрахувати) |
| - заміна частини конструкції; | - простої; |
| - використання спеціальних сплавів; | - втрата готової продукції; |
| - (не)металеві покриття; | - втрата потужності; |
| - спец. засоби протикорозійного захисту; | - забруднення продукції; |
| - розробка нових засобів захисту. | - аварії. |
Під прямими втратамирозуміють вартість заміни (з урахуванням трудо-витрат) прокородувавших конструкцій і машин або їх частин, таких як труби, конденсатори, глушники, трубопроводи, металеві покриття.
Іншими прикладами прямих втрат, можуть служити витрати на перефарбовування конструкцій або експлуатаційні витрати, пов'язані з катодним захистом трубопроводів. Прямі втрати включають додаткові витрати, пов'язані з використанням корозійностійких металів і сплавів замість вуглецевої сталі, навіть коли вона володіє необхідними меха-нічними властивостями, але не має достатній корозійній стійкості. Сюди відносяться також вартість нанесення захисних металевих покриттів; вартість інгібіторів корозії, витрати на кондиціонування повітря складських приміщень для зберігання металевого обладнання.
Набагато важче піддаються підрахунку непрямі втрати, але навіть за наближеною оцінкою вони обчислюються мільярдами доларів .
Простої. Заміна труби нафтоперегінної установки, що прокородувала, коштує декілька сотень доларів, але недовиробіток продукції за час простою може принести збиток до 20 000 доларів в годину. Загальна вартість недовиробітку електроенергії в США із-за корозійних простоїв складає десятки мільйонів доларів в рік .
Втрата готової продукції.У міжремонтний період відбуваються витоки нафти, газу і води внаслідок корозійних пошкоджень відповідних систем; корозія автомобільного радіатора веде до втрати антифризу, а витік газу з пошкодженої труби може привести до вибуху.
Втрата потужності. Внаслідок відкладення продуктів корозії погіршується теплопровідність поверхонь теплообміну. Зменшення прохідних перетинів трубопро-водів внаслідок відкладення іржі вимагає підвищення потужності насосів.
У автомобільних двигунах внутрішнього згорання, де поршневі кільця і стінки циліндрів постійно кородують під дією газоподібних продуктів згорання і конденсатів, втрати від збільшення вжитку бензину і масла дорівнює втратам від механічного зносу, а інколи і перевищують їх.
Забруднення продукції внаслідок попадання в неї іонів важких металів. Солі міді прискорюють старіння і псування мила і тим самим зкорочують термін його зберігання. Сліди металів можуть змінювати колір фарбників. Свинцеве устаткування не може бути використане для приготування і зберігання харчових продуктів внаслідок токсичності солей свинцю. До цієї ж групи втрат відноситься псування продуктів харчування внаслідок ржавіння металевих ємкостей.
Допуски на корозію.Надійні дані про швидкість корозії дозволяють точніше оцінити термін експлуатації устаткування і спрощують його проектування. Типовим прикладом допусків на корозію може служити вибір товщини стінок підземних нафтопроводів.
2. Структура металів і її вплив на корозійні процеси
Механізм утворення поверхневих сполук, їх адгезія до металу і властивості впливають на процес корозії. В свою чергу ці показники багато в чому визначаються структуроюі складом металу.
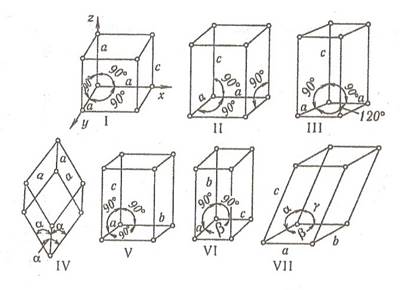
Більшість металів мають кристалічну структуру. У вузлах кристалічної решітки розташовані позитивно заряджені іони (або атоми), а електрони вільно переміщаються в металі.
Найменша частина просторових грат, яким притаманні всі властивості симетрії грат в цілому, називається елементарним осередком. Якщо цей осередок є кубом, то і відповідні грати будуть кубічними.
|
Уряді випадківкристалографічна структура визначає корозійну стійкість металів і їх сплавів.
Реальні металеві матеріали, як правило, є полікристалічними, тобто складаються з безліч окремих кристалів, які в загальному випадку мають неправильну форму і називаються кристалітами або зернами. На відміну від ідеальних кристалів, в яких атоми кристалічної решітки розташовані строго періодично, реальні кристали завжди мають порушення регулярності структури, які називаються дефектами.
Основними причинамивідсутності у реальних конструкційних металевих матеріалів ідеального кристалічного стану є:
- нерівноважні умови кристалізації металу;
|
а г
- присутність в його складі легуючих і домішкових елементів;
- деформація кристалічної решітки внаслідок дії на неї в процесі виготовлен-ня виробів механічних, термічних, радіаційних і інших чинників.[ ].
Дефекти кристалічних решіток змінюють задані властивості металів, впливають на його хімічні і електрохімічні характеристики. Дефекти структури, що виходять на поверхню металу, володіють підвищеною реакційною здатністю і вони є першими осередками корозії. Сторонні домішки концентруються у лінійних дислокаціях і дірках по межах зерен. Ці сегрегації можуть збільшувати окиснення металу, полегшувати утворення піттінгів.
Будь-який вид неоднорідності підсилює як хімічну, так і електрохімічну корозію.Дефекти кристалічної решітки сприяють протіканню в металі процесів дифузії і фазових перетворень.
Процес твердіння рідкого металу супроводжується зміною його агрегатного стану з рідкого на тверде. Структура ближнього порядку змінюється при цьому на структуру дальнього порядку, коли практично у всьому об'ємі матеріалу дотримується регулярне розташування атомів (характерно для кристалічних твердих тіл).
Об'єм тіла при його твердінні зменшується на 2-6%, що є наслідком зменшення міжатомних відстаней. Ефект тим більше, чим компактніша решітка характерна для затверділого металу.
Внаслідок зменшення об'єму металу при його твердінні в структурі реального злитка, як правило, присутні макродефекти -тріщини, раковини, порожнини. Окрім макродефектів затверділий метал містить велика кількість мікродефектів- вакансій, дислокацій, дефектів упаковки, меж розділу.
Будь-який вид неоднорідності, як то за складом, наявністю домішок, осередків залишкової напруги, електропровідності окремих ділянок, приводить до збільшення швидкості корозії. Для того, щоб усунути або зменшити ці явища, проводять такі технологічні операції як загартування, відпал та ін.
У переважній більшості металеві конструкційні матеріали є багатокомпо-нентними сплавами, до складу яких входять легуючі (що вводяться спеціально для додання матеріалу необхідних властивостей) і домішкові (що потрапляють в матеріал з рудними матеріалами в процесі виплавки) елементи. Вступаючи один з одним у взаємодію компоненти сплавів можуть утворювати фази -однорідні за структурою (кристалічній будові) і складу (концентрації ком-понентів) області, обмежені поверхнями розділу.
Конструкційні матеріали, як правило, містять декілька фаз, відносна кіль-кість яких може істотно розрізнятися.
Фази постійного складу називають хімічними сполуками або інтерметалоїдами.
Багато металів піддається алотропічному перетворенню. Алотропічним або поліморфним перетворенням називають зміну грат кристалічного тіла. Така зміна відбувається ізотермічно і характеризується температурою фазової рівноваги двох алотропічних різновидів. Наприклад, залізо при температурах до 910°С і при 1401-1539°С утворює α-фазу і кристалізується у вигляді кубічної об’ємноцентрованої решітки, а в інтервалі температур 910-1401°С утворює γ-фазу у вигляді кубічної об’ємноцентрованої решітки.
1. Класифікація процесів корозії
Корозійні процеси класифікують за механізмом протікання (хімічна та електрохімічна), за умовами протікання ( в залежності від середовища: газова, грунтова, атмосферна і т.д., в залежності від додаткового впливу: контактна, щілинна, радіоційна, під напругою і т.д.), за характером руйнування (табл.1).
Табл.1. Типи корозії за характером руйнування.
| Тип корозії | Характеристика форми корозійного руйнування | Схема типового вигляду корозійного руйнування |
| 1. Суцільна (рівномірна) корозія | Форми корозійного руйнування 1а і 1б відрізняються лише нерівністю поверхні. По зміні форми поверхні до і після корозійного випробування виявляють наявність корозії: вона визначається зміною маси і розмірів зразків до і після корозійного випробування | 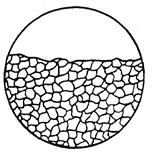 1а
1а
 1б
1б
|
| Форма 1в може бути перехідною між суцільною і вибірковою корозією, наприклад, 10в, 10г і 10е. Тип корозії може бути уточнений по змінах її форми залежно від часу дії корозійного середовища, а також по структурі металу | 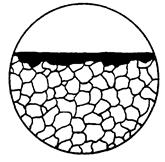 1в
1в
| |
| 2. Місцева (нерівномірна) корозія | Формою відповідає суцільній корозії, але відрізняється тим, що до корозії схильна частина поверхні або корозія протікає з різною швидкістю на його окремих ділянках | - |
| 3. Корозія плямами | Дрібне корозійне руйнування неправильної форми; розмір його площі в разі невеликого збільшення може перевищувати розмір поля зору. | 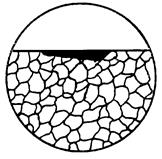
|
| 4. Корозійна виразка | Корозійне руйнування глибиною приблизно рівне ширині. | 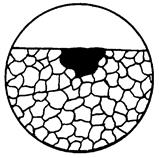
|
| 5. Пітингова корозія | Корозійне руйнування глибиною значно більше ширини. | 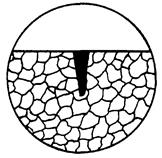
|
| 6. Підповерхне-ва корозія | Корозійне руйнування, характерна тим, що займає на поверхні невелику площу і переважно зосереджена під поверхнею металлу. | 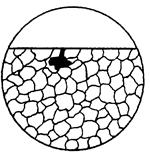 6а
6а
|
| Форма корозійного руйнування, окремі зони якого знаходяться під поверхнею і зазвичай не мають помітного прямого виходу на поверхню. | 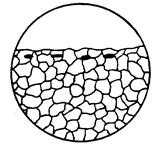 6б
6б
| |
| Форма корозійного руйнування, окремі зони якого знаходяться під поверхнею і зазвичай не мають помітного прямого виходу на поверхню. | 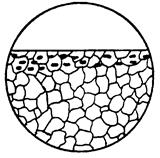 6в
6в
| |
| 7. Шарова корозія | Корозійне руйнування, внутрішні шари якого включають зерна різного розміру, різні фази, включення, виділення і ін. | 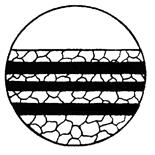
|
| 8. Міжкриста-літна корозія | Корозійне руйнування характерно наявністю зони, що прокородувала вздовж границі зерен металу, причому може зачіпати границі всіх зерен або тільки окремих зерен. | 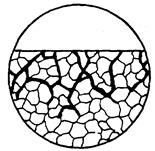
|
| 9. Транскриста-літна корозія | Корозійне руйнування характерно наяв-ністю великої кількості транскристалітних тріщин. | 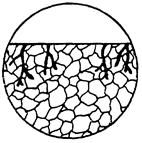
|
| 10. Вибіркова корозія | Корозійне руйнування, до якого схильна певна структурна фаза або компонент; якщо фаза утворена евтектикой, визна-чають, чи прокородувала вся евтектика або деяка її складова, наприклад, цемен-тит | 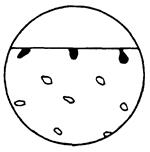 10а
10а
|
| Корозійне руйнування, до якого схильна певна фаза металу без прямого контакту з поверхнею, що прокородувала. У цьому випадку визначають, чи кородують фази на границі зерен або всередині зерен основної структури. Далі визначають, чи не відрізняються границі між фазами, що кородують, від інших меж (наявність фази, тріщин). З цього роблять висновок, чи проникає корозійне середовище по межах зерен або дифузією по всьому об'єму зерен. | 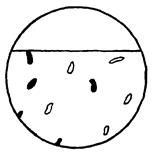 10б
10б
| |
| Корозійне руйнування, до якого схильні тільки окремі зерна, фізичний стан яких змінився, наприклад, внаслідок дефор-мації. | 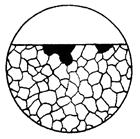 10в
10в
| |
| Корозійне руйнування, до якого схильні тільки частини зерен, що деформуються, при цьому утворюється зона корозійного руйнування вужче, ніж одне зерно і проходить за кілька зерен. Одночасно визначають,чи не вплинула деформація на зміну структури металу, наприклад, перехід аустеніту в мартенсит. | 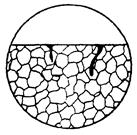 10г
10г
| |
| Корозійне руйнування у вигляді зони з рядами виділених включень; при цьому визначають можливу зміну структури в даній зоні. | 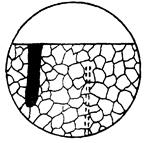 10д
10д
| |
| Корозійне руйнування у вигляді широкої зони уздовж границі зерна. Дана форма може бути тимчасовою і її не можна відносити до міжкристалітної корозії; вона характерна тим, що не проникає в глибину металу. Більш точно її можна визначити по змінах форми ураження корозією в залежності від часу корозійного впливу. | 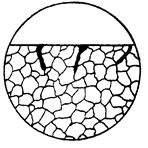 10е
10е
| |
| Корозійне руйнування, в результаті якого утворюється нова фаза металевого виду, що володіє здатністю знижувати стійкість металлу. | 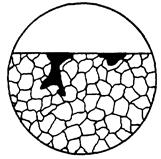 10ж
10ж
| |
| Корозійне руйнування, в результаті якого змінюється хімічний склад фази при збереженні її форми та місця розташування, наприклад, графітизація пластин цементиту в чавуні . В зоні цієї зміни можуть утворюватися і інші продукти корозії, наприклад, оксиди. | 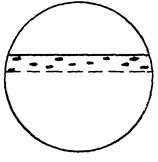 10з
10з
| |
| 11. Корозія в вигляді рідкіс-них тріщин | Корозійне руйнування, в результаті якого утворюється глибока, трохи гілляста тріщина, широка поблизу поверхні з поступовим переходом у незначну ширину; тріщина заповнена продуктами корозії. | 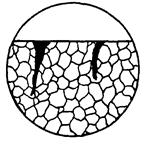 11а
11а
|
| Корозійне руйнування у вигляді глибокої тріщини незначної ширини, що виходить з корозійної виразки на поверхню; тріщина може мати гіллясту форму. | 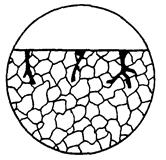 11б
11б
| |
| Корозійне руйнування, в результаті якого утворюється міжкристалітна тріщина незначної ширини при відсутності продуктів корозії. В порівнянні з міжкристалітною корозією має вигляд одиничних (рідкісних) тріщин. | 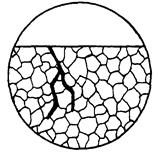 11в
11в
| |
| Корозійне руйнування, в результаті якого утворюється транскристалітна тріщина незначної ширини зі значним розгалуженням. В порівнянні з транскристалітною корозією має вигляд одиничних (рідкісних) тріщин. Деякі тріщини можуть мати тип частково транскристалітного і частково міжкристалітної корозійного руйнування | 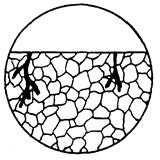 11г
11г
| |
| Корозійне руйнування, в результаті якого утворюються тріщини незначної ширини, що мають вигляд ниток, переважно паралельні поверхні і створюють зону певної глибини. Їх не можна відносити до аналогічних тріщин, що утворюються внаслідок деформації або поганої обробки зразка. | 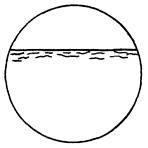 11д
11д
| |
| Корозійне руйнування у вигляді дрібних переважно коротких тріщин всередині окремих зерен. Тріщини можуть утвори-тися, наприклад, внаслідок дії молеку-лярного водню, великої напруги, корозії певної фази. | 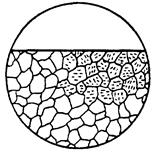 11е
11е
|
Розділ I. ХІМІЧНА КОРОЗІЯ МЕТАЛІВ
Хімічна корозія – це процес самовільного руйнування металів під дією зовнішнього корозійного середовища, при якому окиснення металу і відновлення окисника корозійного середовища протікають в один етап. До хімічної корозії відносять:
а) корозію в рідинах-неелектролітах (неполярні органічні сполуки);
б) газову корозію - корозію при контакті металу із сухими газами при високих температурах (наприклад, корозія матеріалів двигунів внутрішнього згоряння, камер згоряння, реактивних сопел під дією газових продуктів горіння палива та ін.).
Газова корозія- найбільш розповсюджений вид хімічної корозії. Це процес руйнування металів і сплавів в результаті хімічної взаємодії з газами (O2, O3, CO2, CO, N2, NO, NO2, H2S, SO2, Cl2, HCl, Н2О та ін.) при високих температурах, коли неможлива конденсація вологи на поверхні металу. Газова корозія спостерігається при роботі металевих конструкцій, контактних і інших апаратів, арматури випалювальних і нагрівальних печей, деталей двигунів внутрішнього згоряння, при термічній обробці, гарячій прокатці, куванні та ін.
1.1 Термодинаміка газової корозії
Причина газової корозії металів - це їхня термодинамічна нестійкість в даному газовому середовищі при визначених зовнішніх умовах (температурі і тиску).
Типовий випадок газової корозії має місце при взаємодії металу з оксигеном: mМе(т) + n/2 О2(г) 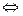 МеmОn (т).
МеmОn (т).
Реакція окиснення є оборотною. Константа рівноваги такої реакції дорівнює:
Кр 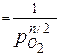
Принципова можливість або неможливість самовільного процесу газової корозії визначається характером зміни термодинамічного потенціалу DGT0 . Якщо при заданих умовах (температурі і тиску) DGT0 < 0, то самовільний процес хімічної корозії можливий, якщо DGT0 > 0 – корозійний процес неможливий (навпаки, можливе відновлення металу з іонного стану). При DGT0 = 0 система знаходиться в термодинамічній рівновазі - корозія неможлива. Формула для розрахунку DGT :
DGT =D 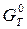 + RT 2,3 lg Kp = - RT 2,3 lg
+ RT 2,3 lg Kp = - RT 2,3 lg 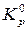 - RT 2,3 lg ((ро2)n/2= - RT 2,3lg
- RT 2,3 lg ((ро2)n/2= - RT 2,3lg 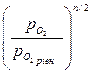
де 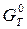 – стандартна енергія Гіббса ,Дж/моль; R – газова постійна, рівна 8,31 Дж/(моль К); Т – абсолютна температура, К;
– стандартна енергія Гіббса ,Дж/моль; R – газова постійна, рівна 8,31 Дж/(моль К); Т – абсолютна температура, К; 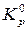 – константа рівноваги хіміч-ної реакції при стандартних умовах; Кр – константа рівноваги хімічної реакції; ро2 - парціальний тиск оксигену, що відповідає вихідному стану системи; (ро2)рівн - парціальний тиск оксигену , що відповідає рівноважному стану системи, Па.
– константа рівноваги хіміч-ної реакції при стандартних умовах; Кр – константа рівноваги хімічної реакції; ро2 - парціальний тиск оксигену, що відповідає вихідному стану системи; (ро2)рівн - парціальний тиск оксигену , що відповідає рівноважному стану системи, Па.
Якщо процес корозії протікає при достатньо високих температурах , то напрямок хімічної реакції окиснення металів визначається парціальним тиском оксигену в газовій суміші (ро2 .) і тиском дисоціації оксиду при даній температурі (рМеО).
mМе(т) + n/2 О2(г) 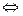 МеmОn (г).
МеmОn (г).
Можливі наступні шляхи протікання цієї хімічної реакції:
а) ро2 = рМеО - парціальний тиск оксигену ( ро2 ) у газовій суміші і тиск дисоціації оксиду ( рМеО)рівні, реакція знаходиться в рівновазі ( корозія не протікає);
б) ро2 > рМеО - реакція зм`іщена вбік утворення оксиду ( корозія протікає);
в) ро2 < рМеО - реакція протікає в зворотному напрямку: оксид буде дисоціювати на чистий метал і оксиген ( корозія не протікає).
Якщо процес окиснення відбувається в повітряній атмосфері, то величину ро2 можна вважати постійною (при атмосферному тиску ро2 = 0,02 МПа). Таким чином, знаючи тиск дисоціації оксиду металу і парціальний тиск оксигену в газовій суміші, можна визначити температурні границі термодинамічної можливості даного процесу.
DGT = - RT 2,3 lg ((ро2)n/2 / (рМеО)
1.2. Механізм газової корозії
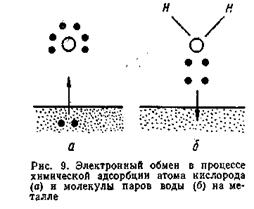
Оксидна плівка, що утворюється на поверхні металу , може захищати метал від подальшого окиснення. Утворення подібної плівки може бути наслід-ком:
1) адсорбції молекул оксигену поверхнею металу, що контактуєз атмосфе-рою;
2) хімічної взаємодії металу і газу з утворенням хімічної сполуки.
|
|
| |
| |
В результаті протікання хімічної реакції
mМе(т) + n/2 О2(г)  МеmОn (т).
МеmОn (т).
і перебудови атомів металу і кисню, відповідною їх просторовому розподілу в
оксиді
а б
утворюється спочатку мономолекулярний (а), а потім полімолекулярний (б) шар оксидів. Надалі атоми кисню дифундують (проникають) через шар оксиду, що утворився, одночасно з цим в протилежному напрямі дифундують іони металу. Реагуючи з киснем, іони металу утворюють оксид, що приводить до появи нових шарів плівки, тобто до її потовщення.
1.3 Іонно-електронна теорія окиснення металів
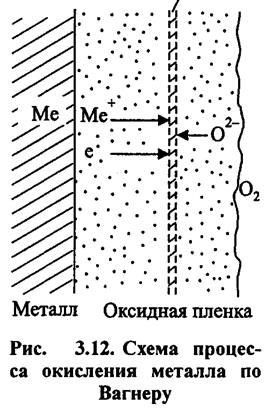
За Вагнером
Іонно-електронна теорія окиснення металів, яка зараз найбільш визнана, була розроблена Вагнером. Він висунув постулат про те, що в плівці відбувається не тільки дифузія іонів за рахунок градієнта концентрацій, але здійснюється, головним чином, направлена міграція іонів в електричному полі, що створюється різницею потенціалів на зовнішній і внутрішній поверхнях оксиду.
Передбачалося, що процес зростання плівки - результат роботи своєрідного гальванічного елементу, у якого поверхня металу на межі з плівкою є анодом, тобто поставляє катіони і електрони, а поверхня плівки на межі з реагентом - катодом, на якому атоми оксигену приймають електрони:
|
| |
|
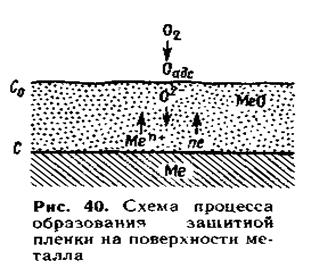
Плівка, володіючи змішаною іонно-електронною проводимістю, працює одночасно як внутрішній і зовнішній ланцюг замкнутого осередку.
Позитивні іони, що утворилися на поверхні металу і електрони переміщаються в плівці роздільно.
Електрони переміщаються з більшою швидкістю. Дифузія іонів протікає в результаті переміщення їх по дефектних місцях кристалічної решітки оксиду.
Адсорбовані з газової фази молекули кисню дисоціюють на зовнішній поверхні оксиду. Атоми кисню, приймаючи електрони, перетворюються на іони О2-, які починають рухатися назустріч іонам металу. Таким чином, зовнішня поверхня плівки, на якій кисень приймає електрони, є катодною поверхнею.
Зустрічна дифузія іонів металу і оксигену протікає в електричному полі. Це означає, що рівняння кінетики і її основні константи можуть бути виведені, виходячи з електричних параметрів і закономірностей: величин іонної і електронної провідності, чисел перенесення іонів і електронів, закону Ома.
|
|
Розраховані по Вагнеру і експериментально набуті значення констант швидкості реакції при газовій корозії деяких металів виявляють велику збіжність.
Константа швидкості окиснення тим більше за інших рівних умов, чим більше зміна вільній енергії і чим вище питома електропроводимість матеріалу плівки. Якщо оксид володіє електроізолюючими властивостями, подальше окиснення не відбувається. Цим пояснюється, наприклад, стійкість алюмінію до процесів окиснення.
1.3 Кінетика хімічної корозії
1.3.1 Закони росту оксидних плівок
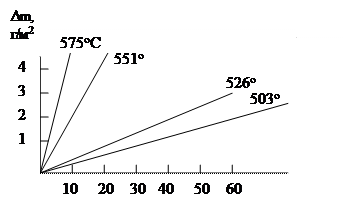
Закон росту оксидної плівкив часі в значній мірі залежить від її захисних властивостей.
У незахисних плівок, наприклад несуцільних , швидкість росту постійна (не залежить від товщини пористої плівки, що утворюєься) і контролюється швидкістю хімічної реакціїутворення плівки з металу і оксигену, що є найбільш загальмованою стадією процесу (кінетичний контроль). У цьому випадку спостерігається лінійний законросту плівки (мал.):
Dm = k1 t, (6)
де Dm — питоме збільшення маси зразка, г/м2;
k1 — постійна величина, г/(м2∙год); t — час окислення металу, год.
 | |||
| |||
час, год
У суцільних плівок, що мають захисні властивості, швидкість росту часто контролюється дифузією реагентів, яка є найбільш загальмованою стадією процесу (дифузійний контроль) і супроводжується самогальмуванням: при потовщенні плівки зменшується швидкість дифузії через неї реагентів (металу і оксигену ), а отже, зменшується і швидкість корозійного процесу. У цьому випадку плівка росте за параболічним законом(мал.2):
Dm2 = k2 t , де k2 — постійна величина, г/(м2∙ год).
∆ m , г/м2
|
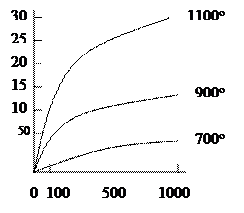
час, хв
Якщо швидкість росту плівки контролюється не тільки швидкістю хімічної реакції , а також і швидкістю дифузії через плівку реагентів (змішаний дифузійно-кінетичний контроль), то ріст плівки може бути описаний квадратним рівнянням Еванса:
k1 Dm2 + k2 Dm = k1 k2 t,
де k1 и k2 — постійні величини.
В ряді випадків гальмування процесу окислення металів спостерігається на більшу величину, чим це випливає з першого закону дифузії (контроль переносом електронів через тонкі плівки шляхом тунельного ефекту або додаткова перешкода дифузії мікробульбашками, що утворюються в плівці). В цих випадках ріст плівки, відбувається за логарифмічним законом
Dm = k3lg t ,
де k3 — постійна величина.
На підставі даних про зміну маси зразка в часі можна одержати рівняння, що дає можливість скласти висновки про механізм і контролюючий фактор процесу.
1.3.2 Властивості захисник плівок
Виникаюча плівка гальмуватиме подальший розвиток корозійного процесу тільки у тому випадку, коли вона володітиме захисними властивостями.
Щоб оксидна плівка мала захисні властивості, вона повинна задовольняти наступним вимогам: бути суцільною, безпористою; мати міцне зчеплення з металом; мати коефіцієнт термічного розширення, близький до величини цієї характеристики для металу; бути хімічно інертною стосовно даного агресивного середовища; мати твердість і зносостійкість. При наявності кристалічної структури оксиду, близької до структури металу, захисні властивості такої плівки будуть кращими ніж при неорієнтованій структурі оксиду стосовно металу. Якщо оксидна плівка, що утворилася, пориста, пухка і має погане зчеплення з металом, то навіть за умови її інертності до даного агресивного середовища вона не буде захисною.
Основною вимогою до оксидної плівки, яка утворюється, є умова її суцільності, що визначається співвідношенням між об’ємом утвореного оксиду (V MeO) і металу, що окиснюється (VМе) і формулюється так: молекулярний об’єм оксидної плівки повинен бути більше атомного об’єму металу.
В цьому випадку можна чекати утворення суцільних плівок. Співвідношення об’ємів оксиду і металу, на якому утвориться плівка, легко підрахувати. Об’єм 1 моль металу дорівнює:
VМе = A/rМе ,
де А — атомна маса; rМе — щільність металу.
Об’єм 1 моль отриманого оксиду дорівнює:
V MeO =М / (n rMе O ) ,
де М— молярна маса оксиду; n— число атомів металу в оксиді; rМе0 — щільність оксиду.
В тому випадку, коли обсяг плівки менше обсягу металу, витраченого на її утворення, тобто
VMeO / VМе = MrМе /(A n rMе O ) < 1 , плівка, що утворюється, несуцільна. Такі плівки не мають захисних властивостей, тому метал піддається подальшій корозії.
Якщо V MeO / VМе = MrМе / (A n rMе O ) > 1,
то в цьому випадку плівка суцільна і може мати захисні властивості.
Виконання умови суцільності плівки завжди є необхідною, але в ряді випадків недостатньою умовою. В реальних умовах у плівок з V MeO / VМе > 1 може і не бути високих захисних властивостей, як наприклад, у МоО3 або WО3. Тому орієнтовно вважають, що при дотриманні умови:
1,0 < V MeO / VМе < 2,5 - плівка суцільна, захисна;
а при V MeO / VМе >2,5 - плівка може бути незахисною,
тому, що в процесі її росту можуть виникати напруги, що руйнують плівку і порушують її суцільність.
1.3.3 Показники корозії
Для кількісного вираження швидкості корозії металів прийнятіпоказники корозії:глибинний, зміни маси, об'ємний, механічний та інші, котрі є середньою швидкістю процесу за час τ .
Показник зміни товщини плівки Kh продуктів корозії, що утворюються на металі: Kh — це зміна товщини плівки Δh в одиницю часу τ (наприклад, мм/рік)
Kh = Δh/ τ
Показник зміни масиKm –цезміна маси зразка металу в результаті корозії, віднесена до одиниці поверхні металу S і до одиниці часу τ [наприклад, г/(м2год)]:
а) позитивний показник зміни маси
K m+= Δm +/S τ ,
де Δm+ — збільшення маси зразка металу (г) за час досліду τ (год);
б) негативний показник зміни маси
Km-= Δm -/S τ = K m+(А /8 n ) ,
де Δm- — втрата маси металу за час досліду τ після видалення продуктів корозії; n – валентність металу.
Глибинний показник корозії (проникнення корозії) KП —цеглибина (середня або максимальна) корозійного руйнування металу П в одиницю часу τ (наприклад, мм/рік):
Кп =П / τ = Km- × 8,7/r,
деr - щільність металу, г/см3.
Глибинний показник корозії придатний як для рівномірної, так і для нерівномірної і місцевої корозії і зручний при порівнянні швидкості корозії різних металів з різною щільністю.
Об'ємний показник корозії КV — це об’єм поглиненого газу або газу , що виділився в процесі корозії металу , (наприклад, оксигену) ΔV, приведений до нормальних умов ( t0 = 0°С и р= 1 атм) і віднесений до одиниці поверхні металу і до одиниці часу [наприклад, см3/(см2 год)]:
КV . = ΔV/ S τ
Механічний показник корозії KMex — це зміна якого-небудь показника механічних властивостей металу за визначений час корозійного процесу, виражена у відсотках. Наприклад, зміна межі міцності металу
Kσ = Δ στ / σо 100% за час τ ,
де στ — зміна межі міцності при розтягуванні за час τ корозії; σо — межа міцності при розтягуванні до корозії.
1.4 Оксидні плівки на поверхні заліза
При високих температурах на залізі можливе утворення наступних сполук: оксид заліза(11) FеО, оксид заліза(II,III) Fе3O4 і оксид заліза а-Fе2Оз(III). Всі ці сполуки виявлені в окалині. Безпосередньо до металу примикає оксид заліза FеО, далі йдують FезО4 і Fе2Оз. Співвідношення товщини оксидів FеО: Fе3О4: Fе2Оз близько до 100:10:1.
Оксид заліза(II) FеО називається вюстіті має кубічну решітку. Кристалографічний осередок містить чотири іони Fе2+ і чотири іони О2-. Оксид стійкий при температурах вьіше 570-575 °С. В окалині вюстіт знаходиться в метастабільному переохолодженому стані. В цьому оксиді міститься кисень в кількостях, що перевищують стехіометричні. Кисень, що розчиняється в оксиді, іонізується, відбираючи електрони у частини двовалентних іонів заліза Fе2+, які переходять в тривалентні іони Fе3+. Як показали рентгенографічні дослідження, при такому процесі утворюється велика кількість вакансій в кристалічній решітці. Це створює сприятливі умови для дифузії Fе2+ і переміщення електронів за допомогою переходу Fе2 = Fе3+ + е-.
Як буде показано далі, вюстіт не володіє захисними властивостями.
Оксид заліза (II,III) Fе3О4 називаєтьсямагнетиті має кристалографічну решітку типу шпінелі. У решітці на кожен іон Fе2+ доводиться два іони Fе3+ у правильному кристалографічному чергуванні.
Fе3О4 володіє електронною провідністю. Це пояснюється тим, що чергування іонів Fе3+-Fе2+-Fе3+ у структурі оксиду забезпечує легкість переходу електрона від одного катіонного вузла до іншого. Магнетит стійкий у всьому інтервалі температур від кімнатної до точки плавлення заліза (1538 °С). Захисні властивості вищі, ніж у вюстіта.
При нагріванні в окисному середовищі до 220 °С магнетит переходить в Fе2О3. В цьому випадку змінюється склад оксиду з Fе3О4 на Fе2О3 без зміни кристалографічної структури. При нагріванні до 400-500 °С утворюється α-Fе2О3.
Оксид заліза (III) — Fе2Оз —називається гематит має структуру ромбоедричної решітки. Гематит існує в широкому інтервалі температур, але вище 1100 °С частково дисоціює.
| Формула оксиду | Назва | Тип решітки | Стійкість | Захисні властивості |
| FeO | вюстіт | кубічна | > 5750 | Fe2+ легко окиснюється до Fe3+, не володіє зах. властивостями |
| Fe3O4 | магнетит | шпінель | до 15380 | електронна проводимість Fe3+- Fe2+- Fe3+ , зах. власт. вище, ніж у FeO. |
| Fe2O3 (α, γ) | гематит | α-ромбоедрич-на або γ-шпінель | до 11000 | високі захисні властивості |
1.5 Вплив зовнішніх і внутрішніх факторів
на швидкість газової корозії
Температура
З підвищенням температури швидкість газової корозії практично у всіх випадках зростає тому, що при цьому збільшується швидкість дифузійних процесів. В той же час, термодинамічна вірогідність здійснення більшості реакцій, які приводять до утворення захисних плівок, з підвищенням температури падає. Внаслідок цього швидкість корозії зростає тільки в рамках термодинамічної вірогідності.
Залежність швидкості корозії від температури виражається рівнянням Ареніуса:
K = Ae -Q/RT ,
(де K – константа швидкості хімічної реакції або коефіціент дифузії; А - константа; е - основа натурального логарифма; Q - ефективна енергія активації процесу; R - газова постійна; T – температура, К. Якщо прологарифмувати рівняння, то отримаємо наступне вираження:
lg K m+ = lgA – Q/(2,3RT),
де Q/(2,3RT) = tg α, α – кут нахилу прямої в координатах lg K m+ = f(1/Т) .
Наведене співвідношення може бути ускладнене або порушене, якщо зі зміною температури змінюється структура або властивості металу або плівки, що утворилася на його поверхні .
Дата добавления: 2015-11-06; просмотров: 979;
