Кавитационная эрозия 2 страница
- електрохімічний захист заснований на катодній поляризації накладенням зовнішнього струму або застосуванні протекторів; анодній поляризації зовнішнім струмом; застосуванні електродренажу, протекторів з випрямлячами (діодами) або секціонування протяжних металоконструкцій за наявності блукаючих струмів;
- застосування конструкційних металевих матеріалів підвищеної корозійної стійкості;
- раціональне конструювання і експлуатація металевих споруд і деталей.
З наукової точки зору класифікувати методи захисту металів від електрохімічної корозії найраціональніше не на основі умов їх застосування або технології здійснення, як це зроблено вищим, а на основі теорії електрохімічної корозії.
Для цієї мети необхідно правильно виявити основний контролюючий чинник захисту для кожного методу, тобто встановити, на який ступінь в ланцюзі послідовних процесів електрохімічної корозії металу даний метод надає основне гальмування.
В табл. 2 представлена раціональна класифікація методів захисту металів від корозії з урахуванням основного чинника захисту для кожного методу.
Таблиця 2. Класифікація методів захисту металів на базі електрохімічної теорії корозії.
| Основний контролюючий чинник захисту в даному методі | Характеристика методу захисту | Приклади | |
| Зменшення ступеня термодинамічної нестабільності | Відділення від корозійного середовища шляхом нанесення ізоляційних покриттів або приміщення виробів в спеціальні контейнери з інертною атмосферою. | • Ізоляційні покриття (полімерні, емалі, мастила). • Застосування інертних атмосфер ( Не, Ar, N2 и др.). | |
| Гальмування катодних процесів | Введення катодних інгібіторів і зниження концентрацій і ефек-тивності катодних деполяризаторів в розчині; застосування катодного електрохімічного захисту. | • Введення As, Bi, Sb при тому, що труїть заліза в кислотну ванну. • Пониження концентрації О2 у розчині. • Зменшення швидкості перемішування розчинів, що аеруються. • Катодна поляризація зовнішнім струмом, застосування анодних протекторів. | |
| Гальмування анодних процесів | Введення позитивних катіонів, що знижують перенапруження катодного процесу в розчин окис-ників або анодних інгібіторів в корозійне середовище або захисне покриття; застосування анодного електрохімічного захисту. | • Введення в корозійний розчин хроматів, нітриту, фосфатів, інших анодних інгібіторів, а іноді і в лакофарбну плівку або мастило. • Анодна поляризація зовнішнім струмом. • Катодні протектори. | |
| Збільшення омічного опору системи | Зменшення електропровідності корозійного середовища; введення в кори. ланцюг напівпровідникових вентилів. | • Осушення ґрунту для зменшення ін-тенсивності макрокорозійних пар. • Усунення вологи з рідкого палива. • Застосування контейнерів з осушеною атмосферою. • Введення ізоляційних прокладок між катодними і анодними ділянками складних конструкцій. • Застосування протекторів, що односторонньо поляризуються , в боротьбі з корозією від змінних блукаючих струмів. | |
| Збільшення омічного опору системи | Зменшення електропровідності корозійного середовища; введення в кори. ланцюг напівпровідникових вентилів. | • Осушення грунту для зменшення ін-тенсивності макрокорозійних пар. • Усунення вологи з рідкого палива. • Застосування контейнерів з осушеною атмосферою. • Введення ізоляційних прокладок між катодними і анодними ділянками складних конструкцій. • Застосування протекторів, що односторонньо поляризуються в боротьбі з корозією від змінних блукаючих струмів. |
Видно, що як способи захисту практичне застосування знаходять методи, що базуються на зменшенні ступені термодинамічної нестабільності, засновані на гальмуванні кінетики катодних і анодних процесів і, в декілька меншого ступеня, впливають через збільшення загального омічного опору корозійної системи.
Найбільш важливі серед численних способів захисту ті, які направлені на підвищення гальмування анодного процесу або, іншими словами, сприяють підтримці корозійних систем в стійкому пасивному стані.
Створення корозійностійких сплавів, наприклад неіржавіючих сталей, застосування анодних інгібіторів і пасиваторів (як у вигляді добавок в корозійні середовища, так і у вигляді захисних полімерних плівок або мастил) також відносяться до цього типу захисту. Останнім часом захист анодним гальмуванням корозійного процесу ще доповнився принципово новим методом, катодним легуванням сплавів і анодною поляризацією зовнішнім струмом (анодний захист) або використанням катодних протекторів .
Якщо відомий основний ступінь, що гальмується даним методом захисту, то заздалегідь можна вказати, в яких умовах застосування цього методу буде ефективнішим. Наприклад, зменшувати швидкість корозії металу шляхом зниження в нім ефективних катодних домішок можна тільки в тих випадках, коли основною контролюючою стадією корозії є перенапруження катодного деполяризуючого процесу (наприклад, в умовах активного розчинення металу в кислотах). В протилежність цьому при корозії з кисневою деполяризацією, коли основним контролюючим чинником є дифузія кисню, підвищення чистоти металу не даватиме позитивного ефекту.
Найбільш досконалими захисними плівками є ті, які забезпечують достатньо повне гальмування анодного процесу вже при утворенні хемосорбційного шару.
3.2 ПРИНЦИПИ ЛЕГУВАННЯ КОРОЗІЙНОСТІЙКИХ СПЛАВІВ
3.2.1 ОСНОВНІ НАПРЯМИ СТВОРЕННЯ КОРОЗІЙНОСТІЙКИХ СПЛАВІВ
Складність явищ, що обумовлюють підвищену корозійну стійкість металевого сплаву в активних середовищах, поки не дозволяє сформулювати науково обгрунтовану теорію «корозійностійкого легування», здатну пояснити і передбачити характер корозійної поведінки різних сплавів в різноманітних умовах їх використання.
Головними напрямами підвищення корозійній стійкості металевих систем і створення сплавів підвищеної стійкості, зокрема, проти електрохімічної корозії являються:
1) зменшення ступеня термодинамічної нестабільності;
2) гальмування катодних процесів;
3) гальмування анодних процесів.
Для побудови корозійностійкого сплава можливе використання будь-якого з цих шляхів при їх розумних комбінаціях.
Зменшення термодинамічної нестабільності сплаву
При утворенні сплаву типу інтерметалевих сполук або твердих розчинів змінюється структура електронних оболонок атомів і, отже, енергетичний стан сплаву. Зазвичай три утворенні сплаву, спостерігається виділення тепла, що загалом відповідає пониженню вільної енергії, отже, характеризує підвищення термодинамічної стабільності сплаву.
Таким чином, існує принципова можливість підвищення термодинамічної стабільності сплавів за рахунок зменшення вільної енергіїреакції їх утворення. Проте, виявилось, що теплові ефектиутворення сплавів порівняно невеликідля того, щоб істотно змінити термодинамічну стабільність технічних (неблагородних) металів у відношенні корозійних реакцій.
Є інша можливість значного підвищення термодинамічної стабільності корозійностійких сплавів типу твердих розчинів, не залежна від енергетичних змін в системі, - це легування коррозіоннонестойкого металу значною кількістю термодинамічно стабільного компоненту, коли досягається криючий («стеричний») механізм захисту, внаслідок утворення на поверхні суцільного шару, що складається з атомів благородного компоненту.
Проте цей шлях підвищення корозійної стійкості сплавів також використовується обмежено внаслідок:
1) необхідності легування значною кількостю благородного компоненту (часто порядка 25 або навіть 50% (атомн.)), що дуже дорого. Практичним прикладом є підвищення корозійної стійкості міді (майже до рівня чистого золота) при легуванні її 50% золота;
2) неможливості отримання багатьох металевих сплавів у вигляді однорідних твердих розчинів (з достатньо великою кількістю легуючого компоненту) із-за обмеженої взаємної розчинності компонентів сплаву в твердому стані.
Гальмування катодних процесів[4, 5]
Цей метод має вельми скромні можливості для розробки корозійностійких сплавів.
Виявилось, що гальмування катодних процесів при легуванні може дати помітний позитивний ефект тільки в тих випадках, коли корозійний процес в основному має катодний контроль, причому гальмування катодного процесу залежить не від концентраційної поляризації, а визначається кінетикою процесувідновлення катодного деполяризатора.
Проте, не дивлячись на вказані обмеження, можна привести приклади з практики, коли зменшення кількості катодних легуючих складових і катодних включеньз низьким перенапруженням відносно катодного процесу (звичайне виділення водню) значно знижує корозійну активність сплаву (наприклад, сильне падіння швидкості корозії в неокисних кислотах цинку, заліза, алюмінію, магнію і ряду інших металів і сплавів при зменшенні кількості катодних компонентів у складі сплаву і особливо гетерогенних катодно-активних включень в структурі сплаву)
Для алюмінію, магнію і їх сплавів подібний вплив катодних включень в сплаві виявляється не тільки в кислих, але і в нейтральних розчинах, оскільки для цих сплавів підвищена швидкість корозії при катодному їх легуванні пов'я-зана із зростанням швидкості водневої деполяризації також і для нейтральних розчинів, що містять хлориди. В подібних випадках гартування сплаву, що приводить до гомогенізації структури, підвищує корозійну стійкість сплаву. Навпаки, відпал або старіння знижують її. Наприклад, загартова-ний дуралюмін, коли його структура гомогенна, стійкіший, ніж відпалений, коли в структурі є катодні включення інтерметалліда СuА12. Окрім скорочення площі включеньв сплаві, зменшення його загальної катодної активності можна досягти збільшенням перенапруженнякатодного процесу на активних катодах. Як ілюстрація можна вказати на підвищення водневого перенапруження і пов'язане з цим зниження швидкості розчинення цинку, що містить домішки заліза, міді або благородних металів, шляхом його легування кадмієм, ртуттю або простим амальгамуванням його поверхні.
За літературними даними можна укласти, що додаткове легування до 0,5-1% Мп технічного магнію і деяких гетерогенних магнієвих сплавів на основі технічного магнію, що містять помітні домішки заліза, значно знижує швидкість їх корозії в розчинах хлоридів.
Це визначається збільшенням катодного перенапруження на залізній мікроструктурній складовій при входженні в неї марганцю, що має вище водневе перенапруження, ніж залізо.
Гальмування анодних процесів [4, 10]
Підвищення корозійної стійкості сплавів за рахунок гальмування анодних процесів, тобто за рахунок підвищення їх пасивності, найефективнішеі отримало широке використання в практиці.
Гальмування анодних процесівпри корозії здійснюєтьсяза рахунок зміни
- складу сплаву
- складу корозійного середовища
- умов протікання корозійного процесу
Нижче буде розглянуто гальмування анодного процесу тільки за рахунок зміни складу металевого сплаву.
Слід розрізняти, принаймні, три можливі напрями:
1) зменшення площі анодних ділянок;
2) легування, що безпосередньо підвищує анодну пасивацію;
3) легування, що підвищує катодну ефективність і що зміщує потенціал корозії сплаву в пасивну область.
Відносне зменшення площі анодних ділянок і поверхні сплаву [4, 5, 100]
В техніці часто зустрічаються гетерогенні металеві сплави. У таких випадках бажано мати сплави з можливо меншою відносною площею анодної складової сплаву. З корозійної точки зору бажано, наприклад, щоб зміцнююча структурна фаза сплавів була анодною по відношенню до основного (катодного) фону сплаву.
У більшості конструкційних сплавів (наприклад, у вуглецевих сталях, високоміцних алюмінієвих сплавах) це правило не виконується. Відомо, що карбід заліза є катодомпо відношенню до α−фериту в сталях и чугунах, γ-фаза (СuА12) — до твердого розчину міді в алюмінії - в дуралюміні. Порівняно рідкісним виключенням є сплав на основі алюмінію, легований магнієм, в якому зміцнююча складова Аl2Мg3 є анодною по відношенню до основного фону.Тому вказаний сплав володіє, як відомо, в порівнянні з дуралюміном підвищеною корозійною стійкістю в морській воді.
В деяких випадках зменшення площі анодів досягається отриманням структури сплаву з більш тонкими межами зерен, наприклад за рахунок підвищення чистоти сплаву або застосування відповідної термічної обробки, що часто використовують для підвищення стійкості неіржавіючих сталей до міжкристалітної корозії.
Легування, що підвищує анодну пасивність сплавів.
Введення в метал або сплав більш пасивуючого легуючого елементу (залежно від умов служби і кількості елементу в сплаві) додає підвищену пасивність сплаву.
Запропоновані пояснення механізму дій подібних пасивуючих добавок зводяться до наступного:
1) виникненню поверхневих шарів із стійких (що пасивуються) -атомів, внаслідок утворення надструктур при утворенні впорядкованих твердих розчинів;
2) зміні внутрішніх структур атомів при утворенні твердих розчинів. Наприклад, по теорії Юліга вважається, що наявність у атома хрому на електронному рівні 3d п'яти вільних місць дозволяє кожному атому хрому відняти у заліза п'ять електронів і перевести в пасивний стан 5 атомів заліза
3) формуванню в початковій стадії корозійного процесу поверхневого шару, збагаченого більш пасивуючим компонентом, як це розвивалося у ряді робіт Грацианським, Сухотіним [127].
Підвищення ефективності к а т о д н и х процесів
(катодне легування)
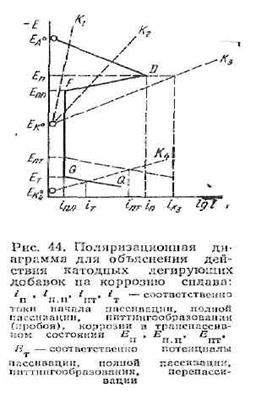
Після обґрунтування електрохімічного механізму корозійного елементу протягом ряду років панувала думка, що всяке збільшення ефективності катодного процесу, наприклад, контакт з більш електропозитивними металами, нанесення несуцільного катодного покриття, легування металу катодною добавкою або навіть введення достатньо позитивних іонів в розчин, повинно викликати прискорення електрохімічної корозії. Принцип захисної дії катодного легування наочно можна пояснити на поляризаційній діаграмі корозії (мал. 44). Швидкість корозії на подібній діаграмі визначається як величина струму в точці перетину катодної і анодної кривих.
|
Важливо відзначити, що для систем (тобто до точки D на анодній кривій), що не пасивуються, завжди із збільшенням катодної ефективності (наприклад, перехід від катодної кривої К1 і К2 на мал. 44) збільшується і швидкість корозії.
Навпаки, для систем , що пасивуються , на діаграмі є широка область потенціалів між потенціалами пасивування Еп і потенціалами транспасивності Ет або потенціалом пітингоутворення Епт, де зростання катодної ефективності приводить не до збільшення, а до зменшення корозійного процесу (наприклад, при переході від катодного процесу К2 до Кз.
Основною умовою досягнення позитивного ефекту при катодному легуванні сплаву є необхідність переміщення його потенціалу в даних умовам корозії в область стійкої пасивності, тобто в область між потенціалами повної пасивації Ет і транспасивності Ет або пітингоутворення Ет. Для здійснення мимовільною пассивіруємості сплаву необхідно, щоб катодний струм і но, який може генерувати дана система при потенціалі пасивування Еп, перевершував граничний анодний струм пасивування, тобто
іКп>іп (см. рис. 44).
В якості катодної легуючої присадки можуть бути використані різні електропозитивні метали { паладій, платина, рутеній і ряд інших металів платинової групи), у деяких умовах навіть і менш благородні метали (реній, мідь, нікель молібден, вольфрам і ін.)
КЛАСИФІКАЦІЯ ОСНОВНИХ ШЛЯХІВ СТВОРЕННЯ КОРОЗІЙНОСТІЙКИХ СПЛАВІВ
Можливі шляхи підвищення корозійної стійкості сплавів можна раціонально класифікувати на базі електрохімічної теорії корозії, виходячи з дії на основний рушійний і гальмуючий чинник корозії (табл. 7).
Залежно від умов корозії обґрунтування для вибору найбільш відповідного сплаву або методу створення нового корозійного сплаву можуть сильно змінюватися.
Так легування сталі значною кількістю хрому (перехід до хромистих сталей) є досконалим методом захисту в умовах роботи сплаву в пасивному стані (анодний контроль), але абсолютно марно при роботі конструкції в неокисному середовищі
(НС1, Н2SО4), в якому корозія цих сталей протікає з катодним контролем.
Легування титану великою кількістю молібдену (до 32%) підвищує стійкість сплаву в солянокислих розчинах, але шкідливо, якщо в них присутні іони-окисники і кисень. Позитивніший ефект в цих середовищах буде отриманий від модифікування титану мізерними присадками паладію (0,2—0,6%). Основне правило: склад сплаву слід міняти так, щоб в передбачуваних умовах експлуатації досягалося подальше підвищення основного контролюючого чинника.
Таблиця 7. Класифікація основних шляхів створення корозійностійких сплавів на базі електрохімічної теорії корозії.
| Характер дії на основний рушійний або гальмуючий чинник корозії | Механізми підвищення корозійної стійкості сплавів | Приклади |
| Зменшення термоди-намічної нестабіль-ності системи | Повышение термодинамической стабильности системы | Легирование меди золотом; никеля – медью; хромистой стали – никелем. |
| Збільшення катодного контролю (катодне гальмування) | Зменшення площі катодних ділянок сплаву | • Збільшення стійкості Zn, Al, Mg, Fe, деяких інших металів і їх сплавів в розчинах HCl, H2SO4, ( для Al, Mg і їх сплавів також в розчині NaСl) із зменшенням вмісту в системі активних катодних домішок. • Перевід катодних включень сплаву в твердий розчин ( наприклад, при гарті вуглецевих сталей або дуралюміна) |
| Введення в сплав добавок, що збільшують перенапру-ження катодної реакції деполяризації ( звичайне перенапруження водню) | • Амальгування технічного Zn. • Легування технічного Zn кадмієм. • Легування технічного Mg або його сплавів марганцем. • Легування латуні миш'яком | |
| Збільшення анодного контролю (анодне гальмування) | Легування, що підвищує анодну пасивність сплаву. | • Легування Fe, Ni або сплавів залізо-нікель хромом. • Легування неіржавіючих сталей добавками Ti, Nb, Ta. |
| Введення в сплав активних катодів ( в умовах можливого пасивування) | • Легування неіржавіючих сталей невеликими добавками Cu, Pd, Pt. • Введення Cu в низьколеговані сталі ( підвищення пасивності в атмосферних умовах). • Легування Ti і його сплавів добавками Pd, Pt або Ru • Легування Nb і його сплавів з Ta платиною. • Легування Pb і його сплавів паладієм. |
3.1 Електрохімічний захист від корозії
Природа процесів корозії в електролітах, як було показано вище електрохімічна. При цьому. корозія є результатом іонізації металу за рахунок віддачі ним електронів окисному компоненту середовища, тобто пов'язана з направленим протіканням струму в системі метал-електроліт. Очевидно, цей процес можна зупинити або припинити шляхом зміни напрями струму або створення умов, що утрудняють віддачу металом електронів. Вирішення вказаних завдань з використанням зовнішнього струму є суттю електрохімічного захисту.
Розрізняють два способиелектрохімічного захисту. Перший з них, такий, що забезпечує зміну напряму струму в системі метал-електроліт, називається катодним захистом. Другий спосіб, що утрудняє або запобігає віддачі металом електронів, називається анодним захистом.
В загальному випадкупід електрохімічним захистом розуміється перевід металу в нереакційно спроможний стан шляхом електродної поляризації.
Катодний захист-спосіб запобігання корозії шляхом катодної поляризації металу із зрушенням його потенціалу в негативну сторону. Катодний захист зводиться до того, щоб забезпечити на поверхні металу можливість протікання тільки (або переважно) катодних процесів.
Анодний захист- спосіб запобігання корозії шляхом анодної поляризаціїметалу із зрушенням його потенціалу в позитивнусторону. Анодний захист зводиться до того, щоб забезпечити створення на поверхні металу захисної пасивуючої плівки.
Електрохімічні способи захисту здійснюються : за допомогою зовнішніх джерел постійного струму або протекторів, що мають в порівнянні з конструкцією, що захищається, потенціал більш негативний при катодному захисті або позитивніший, - при анодній. У вітчизняній літературі і практиці часто електрохімічний спосіб захисту із застосуванням протекторів називається протекторним захистом. Цей термін невдалий, проте для зручності з деякими обмовками ми їмкористуємося.
Таким чином, є принципова можливість катодного і анодного захисту металів від корозії. Проте, як буде показано нижче, величини захисних потенціалів значно відрізняються від теоретичних значень. У багатьох випадках при Е корозія не
припиняється, а посилюється.
3.1.2 Механізм електрохімічного захисту
У всіх електродних процесах суто електрохімічною стадією є тільки стадія розряду - іонізація.
В зв'язку з цим пояснення механізму електрохімічного захисту базується на закономірностях кінетики процесів саме цієї стадії. Механізм електрохімічного захисту пояснюється за допомогою поляризаційних діаграм, що розкривають кінетику електродних реакцій.
Електрохимічний захистполягає в катодній або анодній поляриза-
ції конструкції, що захищається . Він здійснюється приєднанням до кон-струкції ззовні джерела постійного струму або стороннього електрода- про-тектора.Електрохімічний захист підрозділяють на катодний і анодний.
Катодний захистзастосовується для захисту металевих виробів, що знаходяться в грунті, морській воді, а також для захисту апаратури хімічних і інших заводів (холодильники, конденсатори, теплообмінники і ін.), сховищ нафти і ін. Він здійснюється приєднанням металоконструкції до негативного полюса зовнішнього джерела постійного струму або до металу з більш негативним потенціалом (анодний протектор). Таке приєднання перетворює металокон-струкцію на катод і : тим самим захищає метал від руйнування.
При катодному захисті за допомогою джерела постійного зовнішнього струму (мал. 1) в якості допоміжного електрода (анода) використовують нерозчинні матеріали (графит, вугілля) або металевий лом (рейки, старі труби і т. д.), що розчиняється, який періодично потрібно відновлювати.
При використанні анодного протектора створюється гальванічний елемент,в якому металоконструкція є катодом, а протектор - розчинним анодом (мал. 23). В якості протектора ви-
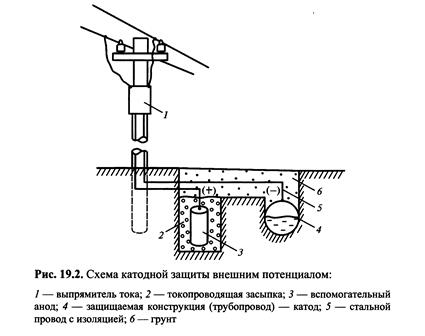
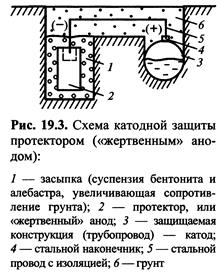
користовують магній, цинк і їх сплави. Протектор працює ефективно, якщо перехідний опір між ним і корозійним середовищем невеликий. При захисті виробу, лежачого в грунті, протектор поміщають в наповнювач - суміш неорганічних солей з глиною, що знижують перехідний опір. Площа протектора повинна складати 0,2-0,5 % від площі конструкції, що захищається. Ефективність катодного захисту оцінюють по захисному ефекту Z (у %) і коефіцієнту захисної дії К. Захиснийефект визначають по формулі
Z =( ( K1 -К2)/ К1 )100,
де K1 - швидкість корозії металу без електрозахисту і К2 - із електрозахистом відповідно, г/(м2год). Коефіцієнт захисної дії Kрівний
де зменшення маси метала без електрозахисту і з ним відповідно, г/м2; щільність катодного струму, А/м2.
Ефективність катодного захисту зростає, якщо її застосовувати спільно із захисними покриттями, наприклад з нанесенням бітумного покриття на трубопроводи.
При використанні катодного захисту, особливо за допомогою зовнішнього джерела постійного струму, можна забезпечити повний захист металокон-струкції від корозії, т. е. досягти Z = 100%. Для цього потрібно, щоб потенціал металу, що захищається, був рівний рівноважному.
Анодний захистзастосовується для захисту апаратури, виготовленої з неіржавіючих і вуглецевих сталей, титану, цирконію і т. д., при роботі в сильно агресивних середовищах. Його використовують також часто з метою зниження забруднень агресивного середовища продуктами корозії.
Анодний захистзастосовується тільки в тих випадках, коли метал або сплав здатні перейти в пасивний стан.
Анодний захист здійснюється приєднанням виробу, що захищається, до позитивного полюса зовнішнього джерела постояного струму або до металу з більш позитивним потенціалом (катодний протектор). При цьому потенціал металу, що захищається, повинен зміститися в область стійкого пасивного стану ( мал. 6).
Катоди, що використовуються при анодному захисті від зовнішнього джерела. струму, повинні мати високу стійкість в корозійному середовищі. Вибір матеріалу катода визначається характером середовища. Крім платини, застосовують хромонікелеві сталі(для кислот), силікатний чавун (для розчинів неорганічних солей, сірчаної кислоти), нікель (для лужних середовищ).
В якості катодного протектор можна використовувати такі матеріали, як углеграфіт, диоксид марганцю, магнетит, диоксид свинцю, що мають досить великий позитивний потенціал. Швидкість корозії при анодному захисті може бути знижена до мінімальної величини, відповідно до струму повної пасивації (див. мал. 6), але ніколи не зменшується до нуля, як у разі катодного захисту.
СПОВІЛЬНЮВАЧІ ЕЛЕКТРОХІМІЧНОЇ
КОРОЗІЇ МЕТАЛІВ
Сповільнювачами або інгібіторамикорозії називають речовини, які при введенні їх в корозійне середовище в незначній кількості помітно знижують швидкість електрохімічної корозії металу або сплаву.
За своєю природою сповільнювачі корозії бувають іонними або молекулярними сполуками..
Сповільнювачі адсорбуються на поверхнікородуючого металу електростатично (адсорбція іонів і полярних молекул за рахунок кулонівських сил при відповідному знаку заряду поверхні металу) або специфічно (адсорбція поверхнево активних іонів і молекул за рахунок молекулярних ван-дерваальсових сил), або хімічно (хемосорбція іонів і молекул за рахунок валентних сил хімічної спорідненості); можлива також адсорбція їх унаслідок одночасної дії різних сил.
За механізмом гальмуючої дії на електрохімічний процес корозії сповільнювачі підрозділяють на анодні, катодні, такі, що екранують (плівкоутворювачі) і змішані.
Сповільнювачі, адсорбуючись на поверхні кородуючого металу, або гальмують протікання анодного або катодного процесу електрохімічної корозії, або, утворюючи екрануючу плівку, ізолюють метал від електроліту, або мають змішаний характер уповільнюючої дії.
За складом розрізняють неорганічні і органічнісповільнювачі корозії. Присутність в органічних сповільнювачах полярних атомів __________ сприяє їх адсорбції на поверхні металів.
Анодні сповільнювачі електрохімічної корозії металів- окисники (пасиватори): кисень, нітрит, хромати і ін. - уповільнюють корозію, пасивуючи метали, тобто утрудняючи протікання анодного процесу.
На мал. 113 дана схема плівкового механізму уповільнюючої дії хромат-іона на корозію заліза: хромат-іон реагує з іоном заліза, що виник в порі захисної оксидної плівки (мал. 113,а), і утворює нерозчинну сполуку (мал. 113,6), яка, осідаючи, закриває пору і перешкоджає корозії заліза (рис 113, в).
Дата добавления: 2015-11-06; просмотров: 891;
